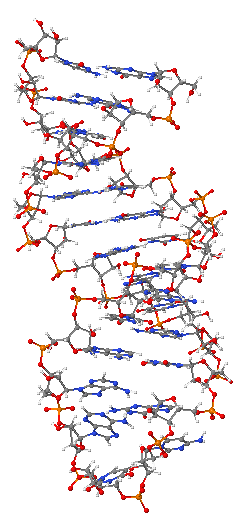
Ribonükleik asid (RNA), bir nükleik asittir, nükleotitlerden oluşan bir polimerdir. Her nükleotit bir azotlu baz, bir riboz şeker ve bir fosfattan oluşur. RNA pek çok önemli biyolojik rol oynar, DNA'da taşınan genetik bilginin proteine çevirisi (translasyon) ile ilişkili çeşitli süreçlerde de yer alır. RNA tiplerinden olan mesajcı RNA, DNA'daki bilgiyi protein sentez yeri olan ribozomlara taşır, ribozomal RNA ribozomun en önemli kısımlarını oluşturur, taşıyıcı RNA ise protein sentezinde kullanılmak üzere kullanılacak aminoasitlerin taşınmasında gereklidir. Ayrıca çeşitli RNA tipleri genlerin ne derece aktif olduğunu düzenlemeye yarar.

Soy gaz veya asal gaz, standart şartlar altında her biri, diğer elementlere kıyasla daha düşük kimyasal reaktifliğe sahip, kokusuz, renksiz, tek atomlu gaz olan kimyasal element grubudur. Helyum (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe) ve radon (Rn) doğal olarak bulunan altı soy gazdır ve tamamı ametaldir. Her biri periyodik tablonun sırasıyla ilk altı periyodunda, 18. grubunda (8A) yer alır. Grupta yer alan oganesson (Og) için ise önceleri soy gaz olabileceği ihtimali üzerinde durulsa da günümüzde metalik görünümlü reaktif bir katı olduğu öngörülmektedir.

Teflon, politetrafloroetilen (PTFE) polimerin ticârî adıdır. PTFE, florlanmış etilen polimerdir. Monomeri tetrafloroetilendir.

Karbonhidrat, karbon (C), hidrojen (H) ve oksijen (O) atomlarından oluşan, genellikle hidrojen-oksijen atomu oranı (suda) 2:1 olan bir biyomoleküldür ve dolayısıyla ampirik (deneysel) formülü Cm(H2O)n şeklindedir. m, n'den farklı da olabilir olmaya da bilir. Ancak, tüm karbonhidratlar bu kesin stokiyometrik tanıma uymaz (örneğin üronik asitler, fukoz gibi deoksi şekerler) ve bu tanıma uyan tüm kimyasallar otomatik olarak karbonhidratlar (örneğin formaldehit ve asetik asit) olarak sınıflandırılmaz.

Kimya'da, hidrojen bağı öncelikle daha elektronegatif bir "verici" atom veya gruba (Dn) kovalent bağla bağlanan bir hidrojen (H) atomu ile ve yalnız bir çift elektron taşıyan başka bir elektronegatif atom arasındaki elektrostatik çekim kuvvetidir.
Pozitron emisyon tomografisi adı verilen ve damar yolu ile enjekte edilen metabolik radyoaktif ajanların biriktiği normal veya patolojik dokuları görüntüleyen bir sintigrafi ve tomografi tekniği. Genel anlamda metabolik veya fonksiyonel görüntüleme için kullanılır.

Kimyasal bileşik, kimyasal bağlarla bir arada tutulan birden fazla kimyasal elementin atomlarını içeren birçok özdeş molekülden oluşan kimyasal maddedir. Dolayısıyla tek bir elementin atomlarından oluşan bir molekül bileşik değildir. Bir bileşik, diğer maddelerle etkileşimi içerebilen kimyasal reaksiyonla farklı bir maddeye dönüştürülebilir. Bu süreçte atomlar arasındaki bağlar kırılabilir ve/veya yeni bağlar oluşabilir.
Trans yağ, trans-izomer (E-izomer) doymamış yağ asitlerine verilen yaygın ad. Terim çift karbon-karbon bağının konfigürasyonuna işaret ettiğinden trans yağlar bazen tekli bazen de çoklu doymamış yağ olabilir, ama hiçbir zaman doymuş yağ olamaz.
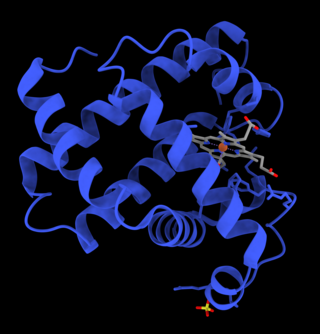
Miyoglobin ; genel olarak omurgalılardaki ve hemen hemen tüm memelilerdeki kas dokusunda bulunan demir ve oksijen bağlayıcı bir proteindir. Miyoglobin, yapısı çözümlenen ilk protein niteliğindedir. 1958'de ilk kez Max Perutz ve Sir John Cowdery Kendrew tarafından kristalografi ile yapısı çözümlenmiştir. Miyoglobin, kanda bulunan, bundan ziyade kırmızı kan hücresinde bulunan demir ve oksijen bağlayıcı niteliğe sahip olan hemoglobin ile uzaktan bir ilişkisi bulunmaktadır. Miyoglobin kas dokusundan başka bir dokuda bulunamaz, ancak kas dokusunda oluşan bir yaralanma sonucunda kan dolaşımına katılabilir. Kanda bulunuşu sıra dışı bir durum olarak görülebilen miyoglobin, tanısal bir belirteç olabilir. Kas hasralanmasına duyarlı olan miyoglobin, göğüs ağrısı olan hastalarda kalp krizi için potansiyel bir belirteçtir. Ancak miyoglobinin kalp krizi tanısındaki özgünlüğü düşüktür; tanı koyulurken CK-MB, cTnT, EKG ve klinik bulguların dikkate alınması gerekmektedir. Rabdomiyoliz gibi kas hasarlanması sonucunda kandaki yoğunluğu artan miyoglobin, böbreklerce süzülür; ancak bu durum böbrekteki renal tübüler epiteller için toksiktir ve akut böbrek yetmezliğine neden olabilir.
Retinal, retinaldehit olarak da bilinir. Başlangıçta retinen olarak adlandırılmıştı ve A vitamini aldehiti olduğu keşfedildikten sonra yeniden adlandırıldı. Retinal, A vitamininin birçok vitamerinden biridir. Retinal, opsin olarak adlandırılan proteinlere bağlanan ve hayvanlarda görme olayının kimyasal temeli olan bir polien kromoforudur. Retinal bazı mikroorganizmalarda ışığın metabolik enerjiye dönüşmesini sağlar.

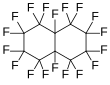
Florokarbonlar, bazen perflorokarbon veya PFC olarak da anılır, CxFy formülüne sahip organoflor bileşikleridir. Sadece karbon ve flor içerirler fakat terminoloji her zaman çok sıkı takip edilmemektedir. Perfloro- ön ekine sahip bileşikler, heteroatomlu olanlar da dâhil olmak üzere hidrokarbonlardır, burada tüm C-H bağları C-F bağlarıyla değiştirilmiştir. Florokarbonlar perfloroalkanlar, floroalkenler ve floroalkinler ve perfloroaromatik bileşikler olabilir. Florokarbonlar ve bunların türevleri floropolimerler, soğutucular, çözücüler ve anestezikler olarak kullanılır.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.

Trioksidan, hidrojen trioksit veya dihidrojen trioksit olarak da adlandırılan, H[O]3H (H2O3 olarak da yazılır) kimyasal formülüne sahip bir inorganik bileşiktir. Kararsız hidrojen polioksitlerdendir. Sulu çözeltilerde, trioksidan su ve tekli oksijen oluşturmak için ayrışır:
Nitrolama bir nitro grubunun organik kimyasal bileşik içine sokulması için genel bir kimyasal proses sınıfıdır. İfade daha genel olarak, ayrıca nitrogliserin sentezinde olduğu gibi alkoller ve nitrik asit arasında farklı nitrat esterleri oluşturma işlemine yanlış olarak uygulanır. Nitro bileşiklerinin ve nitratların ortaya çıkan yapısı arasındaki fark nitro bileşiklerindeki azot atomunun doğrudan oksijen olmayan bir atoma genel olarak da karbon veya başka azot atomuna bağlanmasıdır. Oysaki organik nitratlar olarak da adlandırılan nitrat esterlerinde, azot bir oksijen atomuna genellikle dolayısıyla da bir karbon atomu 'na bağlanır.
Cinsiyet kimliği, kişinin kendi cinsiyetine ilişkin kişisel duygusudur. Cinsiyet kimliği, bir kişinin atanmış cinsiyetiyle ilişkili olabilir veya ondan farklı olabilir. Çoğu bireyde, cinsiyetin çeşitli biyolojik belirleyicileri, bireyin cinsiyet kimliğiyle uyumludur ve tutarlıdır. Cinsiyet ifadesi tipik olarak bir kişinin cinsiyet kimliğini yansıtır, ancak bu her zaman böyle değildir. Bir kişi, belirli bir toplumsal cinsiyet rolüyle tutarlı davranışlar, tutumlar ve görünümler ifade etse de, bu tür ifadeler mutlaka cinsiyet kimliklerini yansıtmayabilir. Cinsiyet kimliği terimi, 1964 yılında psikiyatri profesörü Robert J. Stoller tarafından icat edildi ve psikolog John Money tarafından popüler hale getirildi.

Cis, biyolojik cinsiyeti ile cinsiyet kimliği eşleşen kişileri ifade eder. Mesela, birisi biyolojik olarak kadınsa "cis" kadındır. Bu terim transın zıttıdır.
Limonen renksiz bir sıvıdır alifatik hidrokarbon siklik monoterpen olarak sınıflandırılır ve turunçgillerin meyve kabuklarının içindeki yağın ana bileşenidir. D-izomeri doğada daha çok portakal kokusu olarak ortaya çıkan gıda üretiminde kullanılan bir tatlandırıcıdır. Ayrıca kimyasal sentezde öncü ila carvone ve temizlik ürünlerinde yenilenebilir bazlı çözücü olarak da kullanılır. Daha az yaygın olan L- izomer nane yağlarında bulunur ve çam, terebentin benzeri bir kokuya sahiptir. Bileşik iğne yapraklıların reçinesinde özellikle Pinaceae ve portakal yağında bulunan ana uçucu monoterpenlerden biridir. Limonen adını Fransızca lemondan ("limon") alır. Limonen bir kiral moleküldür ve biyolojik kaynaklar bir enantiyomer üretir: ana endüstriyel kaynak narenciye (R)-enantiyomer olan D-limonene((+)- limonen) içerir. D-Limonen ticari olarak iki ana yöntemle turunçgillerden elde edilir: santrifüjlü ayırma veya buharla damıtma.==Kimyasal reaksiyonlar==Limonen nispeten kararlı bir mono terpen 'dir ve yüksek sıcaklıklarda izopren oluşturmak için çatlamasına rağmen ayrışma olmaksızın damıtılabilir. Carveol, carvone ve limonen oksit üretmek için nemli havada kolayca oksitlenir. Kükürt ile p-simen şeklinde dehidrojenasyona uğrar.

Kimyada, oktahedral moleküler geometri, bir oktahedronun köşelerini tanımlayan, merkezi bir atom etrafında simetrik olarak düzenlenmiş altı atomlu bileşiklerin veya atom gruplarının veya ligandların şeklini tanımlar. Oktahedronun sekiz yüzü vardır, dolayısıyla octa ön ekini alır. Oktahedron, Platonik katılardan biridir, ancak oktahedral moleküller tipik olarak merkezlerinde bir atom içerir ve ligand atomları arasında bağ yoktur. Mükemmel bir oktahedron Oh nokta grubuna aittir. Oktahedral bileşiklerin örnekleri arasında kükürt hekzaflorür SF6 ve molibden hekzakarbonil Mo (CO)6 gösterilebilir. "Oktahedral" terimi, kimyagerler tarafından, merkezi atoma olan bağların geometrisine odaklanarak ve ligandların kendi aralarındaki farklılıkları dikkate almadan biraz gevşek bir şekilde kullanılır. Örneğin, N-H bağlarının oryantasyonu nedeniyle matematiksel anlamda oktahedral olmayan [Co(NH3)6]3+, oktahedral olarak adlandırılır.
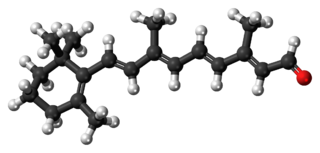
Oleik asit, çeşitli hayvansal ve bitkisel yağlarda doğal olarak bulunan bir yağ asididir. Kokusuz, renksiz bir yağdır, ancak ticari numuneleri sarımsı renkte olabilir. Oleik asit kimyasal olarak, tekli doymamış omega-9 yağ asidi olarak sınıflandırılır ve 18:1 cis-9 lipit numarası ile gösterilir. Formülü şu şekildedir: CH3(CH2)7CH=CH(CH2)7COOH. Oleik asit ismi yağ anlamına gelen Latince oleum kelimesinden türemiştir. Doğada en yaygın bulunan yağ asididir. Oleik asidin tuzları ve esterleri oleatlar olarak adlandırılırlar.

Kimyada ikili bağ veya çift bağ, iki atom arasında, tekli bağdaki iki elektrona karşılık dört bağ elektronu içeren kovalent bir bağdır. İkili bağlar en yaygın olarak iki karbon atomu arasında, örneğin alkenlerde meydana gelir. Birçok ikili bağ iki farklı element arasında bulunur: örneğin, bir karbon atomu ile bir oksijen atomu arasındaki bir karbonil grubunda. Diğer yaygın ikili bağlar azo bileşiklerinde (N=N), iminlerde (C=N) ve sülfoksitlerde (S=O) bulunur. Bir iskelet formülünde, bir ikili bağ, bağlı iki atom arasında iki paralel çizgi (=) olarak çizilir; tipografik olarak bunun için eşittir işareti kullanılır. İkili bağlar kimyasal gösterimde Rus kimyager Alexander Butlerov tarafından tanıtılmıştır.
 cis
cis trans
trans