
Proteinler, bir veya daha fazla uzun amino asit artık zincirini içeren büyük biyomoleküller ve makromolekül'lerdir. Proteinler organizmalar içinde, hücrelere yapı ve organizmalar sağlayarak ve molekülleri bir konumdan diğerine taşıyarak metabolik reaksiyonları katalizleme, DNA kopyalama, uyaranlara yanıt verme dahil olmak üzere çok çeşitli işlevler gerçekleştirir. Proteinler, genlerinin nükleotit dizisi tarafından dikte edilen ve genellikle faaliyetini belirleyen özel 3D yapıya protein katlanmasıyla sonuçlanan amino asit dizilimlerinde birbirlerinden farklıdır.

Amino asitler, proteinleri oluşturan temel yapı taşlarıdır.
N-asetil muramik asit ile N-asetil glikoz amin şeker molekülleri ile az sayıda L-alenin, D-alenin, D-gulutamik asit, lizin veya diaminopimelik asitten oluşur. Peptidoglikan tabaka sadece prokaryot hücrelerde bulunur. Şekerin, kovalent bağ ve amino asitlerle çapraz bağlanmasıyla glikan zincirleri oluşur. Amino asitlerden oluşan tetra peptidin, çapraz bağlarla bağlanmasıyla oluşur. İçinde peptit bağı vardır. Yağlarla birleşerek karbonhidratları oluşturur. Bakteri hücre duvarlarının bir bileşenidir.

Hemoglobin, solunum organından dokulara oksijen, dokulardan solunum organına ise karbondioksit ve proton taşıyan protein. Eritrositlerin içerisinde bulunur. Oksijeni +2 değerlikli demir içeren hem molekülleri ile bağlar. Başlıca sentez yeri eritrosit üretimi sırasında kemik iliğidir. Yaş, cinsiyet ve türe göre küçük farklılıklarla da olsa kanda belli bir değerin altında bulunmasına Anemi, yüksek miktarda bulunmasına ise polisitemi denir. Hemoglobinin prostetik grubu hem, proteiniyse globulindir.

Ribozom, tüm canlı hücrelerde bulunan karmaşık moleküler yapıya sahip ve protein oluşturma sürecinde hayati bir rol oynayan bir organeldir. Bu süreç, mRNA çevirisi olarak bilinen bir biyolojik mekanizma aracılığıyla gerçekleşir. Kısaca ribozomlar, haberci RNA (mRNA) molekülleri tarafından sağlanan talimatları takip ederek amino asitleri birbirine bağlar ve polipeptit adı verilen amino asit zincirlerini oluşturur.
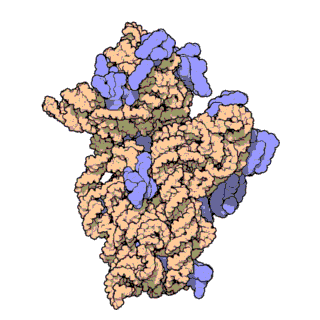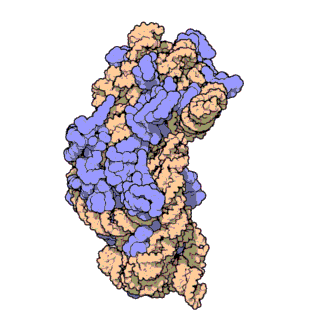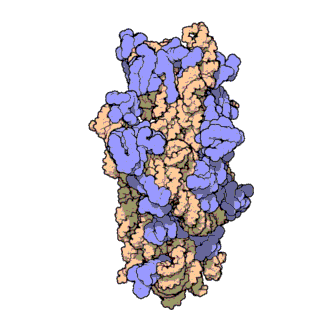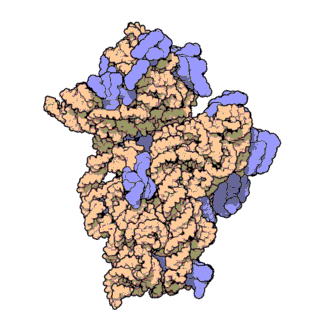
Ribozomal RNA (rRNA), ribozomlarda bulunan bir RNA tipidir, ribozomun protein senteziyle ilişkili katalitik fonksiyonundan sorumludur. Ribozomal RNA'nın görevi, mRNA'daki bilginin translasyon süreci sırasında amino asit dizisine çevrilmesi için taşıyıcı RNA (tRNA) ile etkileşmek ve uzayan peptit zincirine amino asit takmaktır. Hücre sitoplazmasında serbest halde bulunan RNA'nın %80'i rRNA'dan oluşur.

Protein biyosentezi, hücrenin protein sentezlenmesi için gereken bir biyokimyasal süreçtir. Bu terim bazen sadece protein translasyonu anlamında kullanılsa da transkripsiyon ile başlayıp translasyonla biten çok aşamalı bir süreçtir. Prokaryotlarda ve ökaryotlarda ribozom yapısı ve yardımcı proteinler bakımından farklılık göstermesine karşın, temel mekanizma korunmuştur.
Hidroliz işlemi suyu oluşturan hidrojen ve oksijen elementlerinin birbirinden ayrılması ile sonuçlanan bir işlemdir. Bazı kaynaklarda hidroliz, moleküllerin su ilavesiyle daha fazla sayıda parçacık oluşturması olarak da geçer. Hidroliz, su ile bir kimyasal bağın parçalanmasıdır yani bir kimyasal reaksiyondur. Hidroliz genel olarak suyun nükleofil olduğu ikame(yer değiştirme reaksiyonu), eliminasyon(organik reaksiyon türü) ve solvasyon (çözme) reaksiyonları için kullanılır.

Translasyon, transkripsiyon sonucu oluşan mRNA'lardaki koda uygun olarak ribozomlarda gerçekleştirilen amino asit zinciri veya polipeptit sentezi sürecidir, daha sonra üretilen amino asit zinciri veya polipeptit uygun bir şekilde katlanarak etkin bir protein haline gelmektedir. Translasyon, protein biyosentezinin ilk aşamasıdır. 4 harfli DNA dilindeki mesajın 20 harfli amino asid diline çevrilmesinden ötürü, İngilizce terminolojide "çeviri" anlamına gelen translation sözcüğü kullanılmaktadır. Bu terim Türkçeye translasyon olarak geçmiştir. Translasyon hücrenin sitoplazmasında gerçekleşir. Sitoplazmada bulunan iki ribozom alt birimi translasyon sırasında mRNA zincirinin 5' ucuna bağlanır. Ribozom üzerindeki bağlanma bölgelerinde, mRNA'daki baz üçlülerini (kodon) tRNA'daki tamamlayıcıları olan antikodonlara bağlar. mRNA'daki kodonlara karşılık gelen antikodonu bulunduran tRNA'ların art arda eklenmesi sırasında tRNA'nın 3' ucuna bağlanmış olan amino asitler birbirine bağlanarak polipeptit zincirini oluşturur.

Prolin (Pro, P) proteinleri oluşturan 20 aminoasitten biridir. Diğer tüm aminoasitler birincil amin grubu taşımalarına rağmen, prolin, yan zincirindeki üç karbon atomu bir halka oluşturarak tekrar peptid bağındaki nitrojen atomuna bağlandığı için, birincil amin grubundan yoksundur (-NH2). Prolindeki nitrojen(azot) aslında ikincil amin olarak nitelendirilebilir.
Ribozom tarafından protein sentezlenirken; bir amino asidin amino grubuyla, diğerinin karboksilik asit grubunun bir su çekilme tepkimesiyle birbirine bağlanması ile oluşan kimyasal bağ.

Denatürasyon, protein veya nükleik asitlerin doğal yapısında mevcut olan sekonder, tersiyer ve kuaterner yapılarının bazı fiziksel ve kimyasal dış etkilerle bozularak primer yapılarına dönüşmeleri sürecidir. Canlı bir hücredeki proteinlerin denatüre olması, hücresel aktivitelerde bozulma ve belki de hücrenin ölümüyle sonuçlanır.

Çevrim sonrası değişim, bir proteinin çevriminden (translasyonundan) sonra kimyasal değişime uğramasıdır. Çoğu protein için bu değişimler, protein biyosentezinin son adımlarındandır.

Protein ikincil yapısında yaygın bir motif olan alfa sarmal (α-sarmal), sağ-elli burgulu bir biçimdir, omurgadaki her bir N-H grubu, kendinden dört amino asit kalıntısı gerideki omurgadaki C=O grubuna bir hidrojen bağı verir. Bu ikincil yapı bazen klasik Pauling-Corey-Branson alfa sarmalı olarak da adlandırılır. Proteinlerin lokal yapı tipleri arasında α-sarmal, en düzenli olan, diziden öngörüsü yapılması en kolay olan ve ayrıca en yaygın olandır.

Proteinlerin ikincil yapısında β yaprak, alfa sarmaldan sonra en sık görülen biçimdir. Beta yapraklar birbirine en az iki veya üç hidrojen bağı ile yatay bağlanmış beta ipliklerden oluşur, bunlardan plili ve burkulmuş bir yaprak meydana getirir. Bir beta iplik 3 ila 10 amino asit uzunluğunda bir polipeptit zincirinden oluşur, polipeptir omurga neredeyse tamamen uzanık bir konformasyondadır. β yaprakların birleşmesinden kaynaklanan protein yığışımları (agregatlar) ve telcikler (fibriller), çeşitli hastalıkların oluşumunda rol oynar, bunların arasında Alzheimer gibi amiloidoz hastalıkları kayda değerdir.
Düzensiz sarım veya rastgele sarım, monomerlerin rastgele doğrultulu olup buna rağmen bitişik olanların birbirine bağlı oldukları bir polimer konformasyonudur. Belli bir şekil değil, bir makromolekül topluluğundaki tüm şekillerin istatistik bir dağılımıdır. Bu konformasyonun adının arkasında yatan kavram, spesifik, stabilize edici bir etkileşim olmayınca, polimer omurgasının tüm konformasyonları rastgele "örnekleyeceğidir". Çözelti halinde veya ergime sıcaklığının üzerinde olan, çoğu doğrusal, dalsız homopolimer, (yaklaşık) rastgele sarım şeklini alır. Birbirine eşit uzunlukta olmayan monomerlere sahip kopolimerler dahi rastgele sarım dağılımı gösterir, eğer altbirimler arasında spesifik etkileşim yoksa. Dallı polimerlerin parçaları da rastgele sargı şekli alabilir.
Proteinler her organizmada bulunan önemli bir makromolekül sınıfıdır. Proteinler, 20 farklı tip L-α-amino asitten meydana gelen polimerlerdir. Amino asitler birbiriyle reaksiyona girdikten sonra meydana gelen polimerde bu amino asitlerden arta kalan birimlere amino asit kalıntısı denir. 40 kalıntıdan daha kısa olan zincirler için protein yerine genelde peptit terimi kullanılır. Biyolojik fonksiyonlarını yerine getirebilmek için proteinler uzay içinde belli bir biçim alacak şekilde katlanırlar. Bu katlanmayı yönlendiren güçler, protein atomları arasındaki hidrojen bağı, iyonik etkileşimler, van der Waals kuvvetleri ve hidrofobik istiflenme gibi, kovalent olmayan etkleşimlerdir. Proteinlerin işlevlerini moleküler düzeyde anlayabilmek için genelde onları üç boyutlu yapısının çözülmesi gerekir. Protein yapısını çözmek için X-ışını kristalografisi ve NMR spektroskopisi kullanılır, bunlar yapısal biyolojinin başlıca yöntemleri arasında yer alır.

Peptit ve proteinlerin birincil yapısı, bu moleküllerin yapı birimleri olan amino asitlerin doğrusal sırası veya daha genel olarak, bir proteini oluşturan atomlar arasındaki kovalent bağların spesifikasyonudur.

Organik kimyada peptit sentezi, birden fazla amino asidin peptit bağları olarak da bilinen amid bağları ile bağlandığı peptit bileşiklerinin üretimidir. Peptitler, bir amino asidin karboksil grubunun diğerinin amino grubuna yoğunlaşma reaksiyonu ile kimyasal olarak sentezlenir. Koruma grubu stratejileri genellikle çeşitli amino asit yan zincirleri ile istenmeyen yan reaksiyonları önlemek için gereklidir. Kimyasal peptit sentezi, en yaygın olarak peptitin karboksil ucunda (C-terminali) başlar ve amino terminaline (N-terminali) doğru ilerler. Canlı organizmalardaki protein biyosentezi ters yönde gerçekleşir.
Biyosentez, substratların canlı organizmalarda daha karmaşık ürünlere dönüştürüldüğü çok aşamalı, enzim katalizli bir süreçtir. Biyosentezde basit bileşikler modifiye edilir, diğer bileşiklere dönüştürülür veya makromoleküller oluşturmak üzere birleştirilir. Bu süreç genellikle metabolik yollardan oluşur. Bu biyosentetik yollardan bazıları tek bir hücresel organel içinde yer alırken diğerleri birden fazla hücresel organel içinde yer alan enzimleri içerir. Bu biyosentetik yolların örnekleri arasında çift katlı lipit katmanının bileşenlerinin ve nükleotidlerin üretimi yer alır. Biyosentez genellikle anabolizma ile eş anlamlıdır ve bazı durumlarda birbirinin yerine kullanılır.













