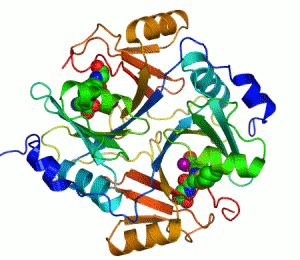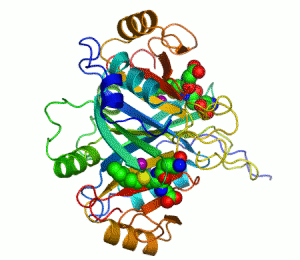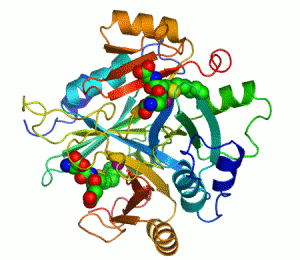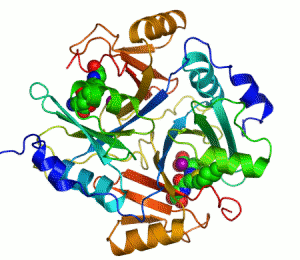
Penisilin bağlayıcı proteinler

| Penisilin bağlayıcı protein, transpeptidaz | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Tanımlayıcılar | |||||||||
| PCN-bd_Tpept | |||||||||
| Pfam | PF00905 | ||||||||
| InterPro | IPR001460 | ||||||||
| OPM süperailesi | 195 | ||||||||
| OPM proteini | 5hlb | ||||||||
| Membranome | 541 | ||||||||
| |||||||||
| Penisilin bağlayıcı protein, dimerizasyon alanı | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Tanımlayıcılar | |||||||||||
| PBP_dimer | |||||||||||
| Pfam | PF03717 | ||||||||||
| InterPro | IPR005311 | ||||||||||
| |||||||||||

Penisilin bağlayıcı proteinler (PBP'ler), penisiline olan yakınlıkları ve bağlanmaları ile karakterize edilen bir grup proteindir. Birçok bakterinin normal bir bileşenidirler; bu isim sadece proteinin keşfedilme şeklini yansıtmaktadır. Tüm β-laktam antibiyotikler (glutamin sentetazı inhibe eden tabtoksinin-β-lactam hariç) bakteri hücre duvarı sentezi için gerekli olan PBP'lere bağlanır. PBP'ler transpeptidazlar olarak adlandırılan bir enzim alt grubunun üyeleridir.
Çeşitlilik
Her organizmada genellikle birkaç tane olmak üzere çok sayıda PBP vardır ve bunlar hem membrana bağlı hem de sitoplazmik proteinler olarak bulunur. Örneğin Spratt (1977), E. coli'nin tüm suşlarında molekül ağırlığı 40.000 ila 91.000 arasında değişen altı farklı PBP'nin rutin olarak tespit edildiğini bildirmektedir.[3] Farklı PBP'ler hücre başına farklı sayılarda bulunur ve penisilin için farklı afinitelere sahiptir. PBP'ler genellikle yüksek molekül ağırlıklı (YMA) ve düşük molekül ağırlıklı (DMA) kategoriler olarak sınıflandırılır.[4] PBP'lerden evrimleşen proteinler birçok yüksek organizmada görülür ve memeli LACTB proteinini içerir.[5]
İşlev
PBP'lerin tümü, bakteri hücre duvarlarının ana bileşeni olan peptidoglikan sentezinin son aşamalarında yer alır. Bakteriyel hücre duvarı sentezi, bakterilerde büyüme, hücre bölünmesi (dolayısıyla üreme) ve hücresel yapının korunması için gereklidir.[2] PBP'lerin inhibisyonu, hücre duvarı yapısında kusurlara ve hücre şeklinde düzensizliklere, örneğin filamentasyona, psödomultisellüler formlara, sferoplast oluşumuna yol açan lezyonlara ve nihai hücre ölümü ve lizise yol açar.[6]
PBP'lerin lipid ara ürünlerinden çapraz bağlı peptidoglikan sentezleme sürecinde yer alan bir dizi reaksiyonu katalize ettiği ve D-alaninin peptidoglikan öncülünden uzaklaştırılmasına aracılık ettiği gösterilmiştir. Saflaştırılmış enzimlerin aşağıdaki reaksiyonları katalize ettiği gösterilmiştir: D-alanin karboksipeptidaz, peptidoglikan transpeptidaz ve peptidoglikan endopeptidaz. Üzerinde çalışılan tüm bakterilerde, enzimlerin yukarıdaki reaksiyonlardan birden fazlasını katalize ettiği gösterilmiştir.[3] Enzimin penisiline duyarsız bir transglikozilaz N-terminal alanı (lineer glikan iplikçiklerinin oluşumunda rol oynar) ve penisiline duyarlı bir transpeptidaz C-terminal alanı (peptit alt birimlerinin çapraz bağlanmasında rol oynar) vardır ve aktif bölgedeki serin, PBP ailesinin tüm üyelerinde korunur.[4]
Bazı düşük molekül ağırlıklı PBP'ler MreB hücre iskeleti ile ilişkilidir ve hücre büyümesi sırasında petipdoglikanı yönlendirilmiş bir şekilde yerleştirerek hücre etrafındaki dönüşünü takip eder.[7] Buna karşılık, yüksek molekül ağırlıklı PBP'ler MreB'den bağımsızdır ve peptidoglikandaki kusurları tespit edip onararak hücre duvarı bütünlüğünü korur.[8]
Antibiyotikler
PBP'ler β-laktam antibiyotiklere bağlanırlar çünkü kimyasal yapı olarak peptidoglikanı oluşturan modüler parçalara benzerler.[9] Penisiline bağlandıklarında, β-laktam amid bağı koparak PBP'lerin aktif bölgesindeki katalitik serin kalıntısı ile kovalent bir bağ oluşturur. Bu geri dönüşü olmayan bir reaksiyondur ve enzimi inaktive eder.
Antibiyotikler ve direnç üzerindeki rolleri nedeniyle PBP'ler üzerine çok sayıda araştırma yapılmıştır. Bakteriyel hücre duvarı sentezi ve sentezinde PBP'lerin rolü, seçici toksisite ilaçları için çok iyi bir hedeftir çünkü metabolik yollar ve enzimler bakterilere özgüdür.[10] Antibiyotiklere karşı direnç, PBP'lerin aşırı üretimi ve penisilinler için düşük afiniteye sahip PBP'lerin oluşumu (laktamaz üretimi gibi diğer mekanizmaların yanı sıra) yoluyla ortaya çıkmıştır. Bu deneyler, proteine farklı amino asitler ekleyerek PBP'nin yapısını değiştirmekte ve ilacın proteinle nasıl etkileşime girdiğine dair yeni keşiflere olanak sağlamaktadır. PBP'ler üzerinde yapılan araştırmalar, yeni yarı sentetik β-laktamların keşfedilmesine yol açmıştır; burada orijinal penisilin molekülü üzerindeki yan zincirlerin değiştirilmesi, PBP'lerin penisiline olan afinitesini artırmış ve böylece direnç geliştiren bakterilerde etkinliği artırmıştır.
Penisilin bağlayıcı protein 2A (PBP2A) proteininin varlığı, metisiline dirençli Staphylococcus aureus'ta (MRSA) görülen antibiyotik direncinden sorumludur.[11]
β-laktam halkası, tüm β-laktam antibiyotiklerde ortak olan bir yapıdır.[12]
Diğer resimler
![Penisilin çekirdeği.[13]](https://upload.wikimedia.org/wikipedia/commons/thumb/9/9b/Penicillin_Core.svg/200px-Penicillin_Core.svg.png) Penisilin çekirdeği.[13]
Penisilin çekirdeği.[13]![PBP3 inhibe edildiğinde bazı bakterilerde filamentasyon (elektron mikrografının sağ üst kısmı) meydana gelir.[6]](https://upload.wikimedia.org/wikipedia/commons/thumb/d/d5/Filamentation_1.jpg/200px-Filamentation_1.jpg) PBP3 inhibe edildiğinde bazı bakterilerde filamentasyon (elektron mikrografının sağ üst kısmı) meydana gelir.[6]
PBP3 inhibe edildiğinde bazı bakterilerde filamentasyon (elektron mikrografının sağ üst kısmı) meydana gelir.[6]
Kaynakça
- ^ Sainsbury S, Bird L, Rao V, Shepherd SM, Stuart DI, Hunter WN, Owens RJ, Ren J (January 2011). "Crystal structures of penicillin-binding protein 3 from Pseudomonas aeruginosa: comparison of native and antibiotic-bound forms". Journal of Molecular Biology. 405 (1). ss. 173-84. doi:10.1016/j.jmb.2010.10.024. PMC 3025346 $2. PMID 20974151.
- ^ a b Miyachiro MM, Contreras-Martel C, Dessen A (January 2020). "Penicillin-Binding Proteins (PBPS) and Bacterial Cell Wall Elongation Complexes". Macromolecular Protein Complexes II: Structure and Function. Subcellular Biochemistry. 93. ss. 273-289. doi:10.1007/978-3-030-28151-9_8. ISBN 978-3-030-28150-2. PMID 31939154.
- ^ a b Spratt BG (January 1977). "Properties of the penicillin-binding proteins of Escherichia coli K12,". European Journal of Biochemistry. 72 (2). ss. 341-52. doi:10.1111/j.1432-1033.1977.tb11258.x. PMID 319999.
- ^ a b Basu J, Chattopadhyay R, Kundu M, Chakrabarti P (July 1992). "Purification and partial characterization of a penicillin-binding protein from Mycobacterium smegmatis". Journal of Bacteriology. 174 (14). ss. 4829-32. doi:10.1128/jb.174.14.4829-4832.1992. PMC 206282 $2. PMID 1624470.
- ^ Peitsaro N, Polianskyte Z, Tuimala J, Pörn-Ares I, Liobikas J, Speer O, Lindholm D, Thompson J, Eriksson O (January 2008). "Evolution of a family of metazoan active-site-serine enzymes from penicillin-binding proteins: a novel facet of the bacterial legacy". BMC Evolutionary Biology. Cilt 8. s. 16. doi:10.1186/1471-2148-8-26. PMC 2266909 $2. PMID 18226203.
- ^ a b Cushnie TP, O'Driscoll NH, Lamb AJ (December 2016). "Morphological and ultrastructural changes in bacterial cells as an indicator of antibacterial mechanism of action". Cellular and Molecular Life Sciences. 73 (23). ss. 4471-4492. doi:10.1007/s00018-016-2302-2. hdl:10059/2129. PMID 27392605. 7 Ekim 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Mayıs 2020.
- ^ Dion, Michael F.; Kapoor, Mrinal; Sun, Yingjie; Wilson, Sean; Ryan, Joel; Vigouroux, Antoine; Teeffelen, Sven van; Oldenbourg, Rudolf; Garner, Ethan C. (13 Mayıs 2019). "Bacillus subtilis cell diameter is determined by the opposing actions of two distinct cell wall synthetic systems". Nature Microbiology. 4 (8). ss. 1294-1305. doi:10.1038/s41564-019-0439-0. ISSN 2058-5276. PMC 6656618 $2. PMID 31086310.
- ^ Vigouroux, Antoine; Cordier, Baptiste; Aristov, Andrey; Alvarez, Laura; Özbaykal, Gizem; Chaze, Thibault; Oldewurtel, Enno Rainer; Matondo, Mariette; Cava, Felipe; Bikard, David; van Teeffelen, Sven (6 Ocak 2020). "Class-A penicillin binding proteins do not contribute to cell shape but repair cell-wall defects". eLife. Cilt 9. Jie Xiao (ed.). s. -51998. doi:10.7554/eLife.51998. ISSN 2050-084X. PMC 7002073 $2. PMID 31904338.
- ^ Nguyen-Distèche M, Leyh-Bouille M, Ghuysen JM (October 1982). "Isolation of the membrane-bound 26 000-Mr penicillin-binding protein of Streptomyces strain K15 in the form of a penicillin-sensitive D-alanyl-D-alanine-cleaving transpeptidase". Biochemical Journal. 207 (1). ss. 109-15. doi:10.1042/bj2070109. PMC 1153830 $2. PMID 7181854.
- ^ Chambers HF (March 1999). "Penicillin-binding protein-mediated resistance in pneumococci and staphylococci". Journal of Infectious Diseases. 179 (Suppl 2). ss. S353-9. doi:10.1086/513854. PMID 10081507.
- ^ Ubukata K, Nonoguchi R, Matsuhashi M, Konno M (May 1989). "Expression and inducibility in Staphylococcus aureus of the mecA gene, which encodes a methicillin-resistant S. aureus-specific penicillin-binding protein". Journal of Bacteriology. 171 (5). ss. 2882-5. doi:10.1128/jb.171.5.2882-2885.1989. PMC 209980 $2. PMID 2708325.
- ^ Pandey N, Cascella M (March 2020). "Beta Lactam Antibiotics". StatPearls. PMID 31424895. 15 Aralık 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 1 Mayıs 2020.
- ^ Bardal SK, Waechter JE, Martin DS (January 2011). "Chapter 18 - Infectious Diseases". Applied Pharmacology: 233–291. doi:10.1016/B978-1-4377-0310-8.00018-X. ISBN 9781437703108. 2020-07-05 tarihinde kaynağından arşivlendi. Erişim tarihi: 2020-05-01.