Orthopoxvirus
| Orthopoxvirus | |||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Biyolojik sınıflandırma | |||||||||||||||||
| |||||||||||||||||
| Türler | |||||||||||||||||
| Metne bakınız | |||||||||||||||||
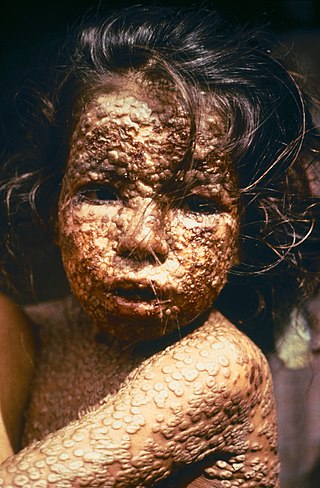
Orthopoxvirus, Poxviridae familyasında ve Chordopoxvirinae alt familyasında yer alan bir virüs cinsidir. Memeliler ve insanlar dahil olmak üzere omurgalılar ve eklem bacaklılar doğal konak olarak hizmet eder. Bu cinste 12 tür bulunmaktadır. Bu cinsle ilişkili hastalıklar arasında çiçek hastalığı, inek çiçeği, at çiçeği, deve çiçeği ve maymun çiçeği bulunur.[1][2] Cinsin en yaygın bilinen üyesi çiçek hastalığına neden olan Variola virüsüdür. Vaccinia virüsünün aşı olarak kullanılmasıyla 1977 yılına kadar küresel olarak ortadan kaldırılmıştır. En son tanımlanan tür, ilk kez 2015 yılında izole edilen Alaskapox virüsüdür.[3]
Mikrobiyoloji
Yapı

Orthopoxvirus'ler tuğla şeklinde geometrilere ve yaklaşık 200 nm genişliğinde ve 250 nm uzunluğunda virion boyutlarına sahip zarflıdır.[1]
Genom
Üye virüsler yaklaşık 170-250 kb uzunluğunda doğrusal çift sarmallı DNA genomlarına sahiptir.[1]
Yaşam döngüsü

Viral replikasyon sitoplazmiktir. Konak hücreye giriş, viral proteinlerin virüsün hücresel endositozuna aracılık eden konak glikozaminoglikanlara (GAG'lar) bağlanmasıyla sağlanır. Viral zarfın plazma membranı ile füzyonu, viral çekirdeği konak sitoplazmasına bırakır. Viral RNA polimeraz tarafından erken faz genlerinin ekspresyonu enfeksiyondan 30 dakika sonra başlar. Erken ekspresyon sona erdiğinde viral çekirdek tamamen kaplanmamış olur ve viral genom sitoplazmaya salınır. Bu noktada, ara genler ifade edilir ve enfeksiyondan yaklaşık 100 dakika sonra viral DNA polimeraz tarafından genomik DNA replikasyonunu tetikler. Replikasyon DNA iplikçiklerinin yer değiştirmesi modelini takip eder. Geç genler enfeksiyon sonrası 140 dakika ila 48 saat arasında ifade edilir ve tüm viral yapısal proteinleri üretir. Sitoplazmik viral fabrikalarda progeni virionların montajı başlar ve küresel bir olgunlaşmamış partikül üretilir. Bu virüs partikülü olgunlaşarak tuğla şeklindeki hücre içi olgun viriona dönüşür ve bu virion hücre parçalandığında serbest kalabilir ya da Golgi aparatından ikinci bir membran edinerek hücre dışı zarflı virionlar olarak tomurcuklanabilir. Bu son durumda virion mikrotübüller aracılığıyla plazma membranına taşınır.[1]
Bulaşma
Ortopoksvirus'lerin doğal konakları memeliler ve eklem bacaklılardır. Üye virüsler solunum damlacıkları, temas ve zoonoz yoluyla bulaşır.[1]
Dağılım
Maymun çiçeği, inek çiçeği ve buffalo çiçeği virüsleri de dahil olmak üzere bazı orthopox virüsleri rezervuar olmayan türleri enfekte etme yeteneğine sahiptir. Ektromelia ve deve çiçeği virüsleri gibi diğerleri ise yüksek oranda konağa özgüdür. Aşı enstitülerinde ve araştırma laboratuvarlarında muhafaza edilen Vaccinia virüsü çok geniş bir konak aralığına sahiptir. Aşı türevi vaccinia, kemirgenlerde, sığırlarda ve hatta insanlarda enfeksiyonlara neden olduğu Brezilya'da vahşi doğada çoğalırken bulunmuştur.[4] Variola virüsünün ortadan kaldırılmasının ardından deve çiçeği, ekonomik açıdan en önemli Orthopoxvirus enfeksiyonlarından biri haline gelmiştir, çünkü geçimlik düzeydeki birçok göçebe topluluk büyük ölçüde develere bağımlıdır.[]
Taksonomi
Bu cins aşağıdaki türleri içerir:
| Türler | Yaygın adı |
|---|---|
| Orthopoxvirus abatinomacacapox | Abatino macacapox virus, orthopoxvirus Abatino |
| Orthopoxvirus akhmetapox | Akhmeta virus |
| Orthopoxvirus camelpox | deve çiçeği virüsü |
| Orthopoxvirus cowpox | sığır çiçeği virüsü |
| Orthopoxvirus ectromelia | ectromelia virüsü |
| Orthopoxvirus monkeypox | maymun çiçeği virüsü |
| Orthopoxvirus raccoonpox | rakun çiçeği virüsü |
| Orthopoxvirus skunkpox | skunkpox virus |
| Orthopoxvirus taterapox | taterapox virus |
| Orthopoxvirus vaccinia | vaccinia virüsü |
| Orthopoxvirus variola | çiçek virüsü |
| Orthopoxvirus volepox | volepox virus |
Alaska çieçği virüsü olarak da bilinen ilgili Borealpox virüsü, 2024 yılı itibarıyla sınıflandırılmamıştır.[3][5]
Evrim
Orthopoxvirus türlerinin evrim sürecinde birçok gen kesilmiş (ancak hala işlevsel), parçalanmış veya kaybolmuştur. İnek çiçeği suşları en sağlam genlere sahip olma eğilimindedir. Filogeniyi sekans veya gen içeriğine göre tahmin etmek biraz farklı sonuçlar üretir:[6]
| Sekansa göre | Gen içeriğine göre | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
|
İki ağaçtaki farklılıkların bir kısmı, aşı suşlarının üretilmesindeki pasaj prosedürüne bağlanmaktadır. Bu bağlamda modifiye vaccinia Ankara suşu in vitro pasajla ilgili olarak çok fazla gen kaybına sahiptir ve doğal bir salgında bulunan bir aşı suşu olan at çiçeği daha az gen kaybına sahiptir.[6]
İnsanlarda enfeksiyon
Zoonozlar
İnsana özgü variola virüsünün (çiçek hastalığı) ortadan kaldırılmasının ardından, tüm insan Orthopoxvirus enfeksiyonları zoonozdur.[7] Maymun çiçeği doğal olarak sadece Afrika'da, özellikle de Demokratik Kongo Cumhuriyeti'nde görülür.[8] Bununla birlikte, Gana'dan ithal edilen hayvanlarla temas nedeniyle ABD'de insan ve çayır köpeği vakaları meydana gelmiş,[9] Mayıs 2022'de ise bir maymun çiçeği salgını küresel olarak yayılmaya başlamıştır. İnek çiçeği sadece Avrupa'da ve komşu Rus eyaletlerinde görülür ve adına rağmen sığırlarda nadiren görülür. Yaygın konaklardan biri, insan enfeksiyonlarının en sık edinildiği evcil kedidir.[10][11] İnek çiçeği virüsü Avrupa'daki hayvanat bahçelerinde filler gibi çeşitli hayvanlara da bulaşarak insanlarda enfeksiyona yol açmıştır.[12]
Laboratuvarda bulaşma
Konsantre virüs aerosolleri, özellikle bağışıklığı olmayan bireylerde Orthopoxvirus enfeksiyonuna neden olabilir.[13] Buna ek olarak, konsantre virüs ile iğne batması veya enfekte hayvanlardan alınan çizikler, bağışıklığı olan bireylerde bile deride lokal enfeksiyona neden olabilir. Avrupa'da sığır çiçeği enfeksiyonu veterinerlik çalışanları ve daha az ölçüde çiftlik çalışanları için mesleki bir tehlikedir.[11]
Belirtiler ve semptomlar
Orthopoxvirus enfeksiyonunun ilk belirtileri arasında ateş, halsizlik, baş ve vücut ağrıları ve bazen kusma yer alır. Maymun çiçeği enfeksiyonu haricinde, tek bir lezyon normdur, ancak kazara otoinokülasyon ile uydu lezyonlar oluşabilir. Enflamatuar doku ile çevrili bireysel lezyonlar gelişir ve maküller, papüller, veziküller ve püstüller yoluyla ilerler ve sonunda kuru kabuklara dönüşür. (Lezyonlar tek başına Orthopoxvirus enfeksiyonu için tanısal değildir ve zoonotik Parapoxvirus enfeksiyonları, şarbon veya Herpesvirus enfeksiyonları ile karıştırılabilir[11]). Şiddetli enfeksiyon vakalarında ciddi ödem ve eritem vücudun geniş alanlarını etkileyebilir. Ensefalit (mental durum değişikliği ve fokal nörolojik defisitler), miyelit (üst ve alt motor nöron disfonksiyonu, duyusal seviye ve bağırsak ve mesane disfonksiyonu) veya her ikisi de Orthopoxvirus enfeksiyonundan kaynaklanabilir. Nadiren beyin-omurilik sıvısında ortopoksvirüsler tespit edilebilir.[]
Spesifik Orthopoxvirus enfeksiyonları ile ilgili olarak, insan maymun çiçeği en çok hafif çiçek hastalığına benzemektedir.[8] İnsan çiçeği nispeten şiddetli lokalize bir enfeksiyondur. 54 vaka üzerinde yapılan bir araştırmada, biri ölüm olmak üzere üç genel enfeksiyon vakası bildirilmiştir.[11]
Tedavi
Enfekte bireylere aşıya özgü immünoglobulinler uygulanabilir. Şu anda Orthopoxvirus enfeksiyonunun komplikasyonlarının tedavisi için mevcut olan tek ürün, vaccinia virüsü ile aşılanmış kişilerden alınan plazmanın immünoglobulin fraksiyonunun izotonik steril bir çözeltisi olan vaccinia immünoglobulindir (VIG). Ekzema vaccinatum ve bazı progresif vaccinia vakalarının tedavisinde etkilidir. Ancak VIG, aşı keratitinin tedavisi için kontrendikedir.
VIG, hasta aşırı derecede hasta ise veya altta yatan ciddi bir hastalığı varsa şiddetli jeneralize vaccinia için önerilir. VIG, aşı sonrası ensefalit tedavisinde hiçbir fayda sağlamaz ve çiçek hastalığının tedavisinde hiçbir rolü yoktur. Mevcut VIG kaynakları sınırlıdır ve kullanımı ciddi klinik belirtileri olan aşı komplikasyonlarının tedavisi için ayrılmıştır. Şu anda mevcut olan VIG için önerilen dozaj 0,6 ml/kg vücut ağırlığıdır. VIG kas içine uygulanmalıdır ve ideal olarak semptomların başlamasından sonra mümkün olduğunca erken uygulanmalıdır.
Terapötik VIG dozları yüksek olabileceğinden (örneğin 70 kg ağırlığındaki bir kişi için 42 ml), ürün 24 ila 36 saatlik bir süre boyunca bölünmüş dozlar halinde uygulanabilir. İyileşme başlayana kadar (yani yeni lezyonlar ortaya çıkmayana kadar) genellikle 2-3 gün aralıklarla dozlar tekrarlanabilir. CDC şu anda siviller için tek VIG kaynağıdır.[]
Tecovirimat (ST-246) gibi bazı antiviral bileşiklerin in vitro ortamda[14] ve test hayvanları arasında vaccinia virüsüne veya diğer orthopoxvirüslere karşı %100 aktif olduğu bildirilmiştir. Tecovirimat'a Gıda ve İlaç İdaresi (FDA) tarafından yetim ilaç statüsü verilmiştir ve şu anda insanlarda güvenliğini ve etkinliğini belirlemek için çalışılmaktadır. Bir başka örnek de brincidofovirdir. Haziran 2021'de FDA bu ilacı insanlarda çiçek hastalığının tedavisi için onaylayarak, etkin bir şekilde nesli tükenmiş bir etki mekanizması için onaylanan ilk ilaç haline getirdi. Bu karar, potansiyel biyolojik silah geliştirilmesine yönelik artan endişeler nedeniyle ajans tarafından yapılan öncelikli incelemenin ardından alındı. Hedef virüs ortadan kaldırıldığı için etkinlik doğrudan doğrulanamamış, ancak Orthopoxvirus'un ilgili türleri tarafından enfeksiyonu takiben hayvanların hayatta kalması yoluyla çıkarım yapılmıştır. Buna karşılık, insanlarda sitomegalovirüs enfeksiyonlarının tedavisinde ilacın denemelerinden elde edilen güvenlik verileri mevcuttu.[15]
FDA tarafından kanser tedavisi için onaylanan bir bileşik olan imatinibin, hücre dışı zarflı viryonların salınımını sınırladığı ve fareleri vaccinia ile ölümcül bir mücadeleden koruduğu gösterilmiştir.[16] Şu anda, imatinib ve ilgili bileşikler CDC tarafından variola virüsü ve mpox virüsüne karşı etkinlikleri açısından değerlendirilmektedir.
Laboratuvar sentezi
2017 yazında Alberta Üniversitesindeki araştırmacılar, kanseri tedavi etmek için virüslerin kullanılmasına yönelik araştırma yapmak üzere laboratuvar sentezi yoluyla at çiçeğini yeniden yarattılar.[17]
Kaynakça
- ^ a b c d e "Viral Zone". ExPASy. 18 Haziran 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Haziran 2015.
- ^ "Virus Taxonomy: 2020 Release". International Committee on Taxonomy of Viruses (ICTV). March 2021. 8 Nisan 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 22 Mayıs 2021.
- ^ a b Gigante, Crystal M.; Gao, Jinxin; Tang, Shiyuyun; McCollum, Andrea M.; Wilkins, Kimberly; Reynolds, Mary G.; Davidson, Whitni; McLaughlin, Joseph; Olson, Victoria A.; Li, Yu (August 2019). "Genome of Alaskapox Virus, a Novel Orthopoxvirus Isolated from Alaska". Viruses (İngilizce). 11 (8). s. 708. doi:10.3390/v11080708. PMC 6723315 $2. PMID 31375015.
- ^ Trindade, Giliane S.; Emerson, Ginny L.; Carroll, Darin S.; Kroon, Erna G.; Damon, Inger K. (1 Temmuz 2007). "Brazilian Vaccinia Viruses and Their Origins". Emerging Infectious Diseases. 13 (7). ss. 965-972. doi:10.3201/eid1307.061404. ISSN 1080-6040. PMC 2878226 $2. PMID 18214166.
- ^ a b "Genus: Orthopoxvirus | ICTV". ictv.global. 18 Ağustos 2024 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Ağustos 2024.
- ^ a b Hendrickson, RC; Wang, C; Hatcher, EL; Lefkowitz, EJ (September 2010). "Orthopoxvirus genome evolution: the role of gene loss". Viruses. 2 (9). ss. 1933-67. doi:10.3390/v2091933. PMC 3185746 $2. PMID 21994715.
- ^ Baxby, Derrick (1988). "Human poxvirus infection after the eradication of smallpox". Epidem, Inf. 100 (3). ss. 321-34. doi:10.1017/s0950268800067078. PMC 2249357 $2. PMID 2837403.
- ^ a b Jezek, Z.; Fenner, F. (1988). Human monkeypox. Basel: Karger. ISBN 3-8055-4818-4.
- ^ Centers for Disease Control Prevention (CDC) (2003). "Update:Multistate Outbreak of Monkeypox - Illinois, Indiana, Kansas, Missouri, Ohio, and Wisconsin, 2003". MMWR. 52 (27). ss. 642-6. PMID 12855947.
- ^ Bennett, M; Gaskell, C.J.; Baxby, D.; Gaskell, R.M.; Kelly, D.F.; Naidoo, J. (1990). "Feline cowpox virus infection". Journal of Small Animal Practice. 31 (4). ss. 167-73. doi:10.1111/j.1748-5827.1990.tb00760.x.
- ^ a b c d Baxby, D.; Bennett, M.; Getty, B. (1994). "Human cowpox 1969-93: a review based on 54 cases". Br. J. Dermatol. 131 (5). ss. 598-607. doi:10.1111/j.1365-2133.1994.tb04969.x. PMID 7999588.
- ^ Kurth, A.; Wibbelt G; Gerber H-P; Petschaelis A; Pauli G; Nitsche A. (April 2008). "Rat-to-Elephant-to-Human Transmission of Cowpox Virus". Emerging Infectious Diseases. 14 (4). ss. 670-671. doi:10.3201/eid1404.070817. PMC 2570944 $2. PMID 18394293.
- ^ Martinez, Mark; Michael P. Bray; John W. Huggins (2000). "A Mouse Model of Aerosol-Transmitted Orthopoxviral Disease". Archives of Pathology & Laboratory Medicine. 124 (3). ss. 362-77. doi:10.5858/2000-124-0362-AMMOAT. PMID 10705388. 23 Ağustos 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Şubat 2018.
- ^ Yang G, Pevear DC, Davies MH, ve diğerleri. (October 2005). "An orally bioavailable antipoxvirus compound (ST-246) inhibits extracellular virus formation and protects mice from lethal orthopoxvirus Challenge". J. Virol. 79 (20). ss. 13139-49. doi:10.1128/JVI.79.20.13139-13149.2005. PMC 1235851 $2. PMID 16189015.
- ^ "FDA approves drug to treat smallpox". FDA. 4 Haziran 2021. 8 Haziran 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Haziran 2021.
- ^ Reeves, P. M.; Bommarius, B.; Lebeis, S.; McNulty, S.; Christensen, J.; Swimm, A.; Chahroudi, A.; Chavan, R.; Feinberg, M. B.; Veach, D.; Bornmann, W.; Sherman, M.; Kalman, D. (2005). "Disabling poxvirus pathogenesis by inhibition of Abl-family tyrosine kinases". Nature Medicine. 11 (7). ss. 731-739. doi:10.1038/nm1265. PMID 15980865.
- ^ Riley, Kim (10 Ağustos 2017). "Bioterrorism threats require common global experimentation oversight, expert says". Homeland Preparedness News (İngilizce). 27 Mayıs 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 7 Kasım 2017.