
Atom veya ögecik, bilinen evrendeki tüm maddenin kimyasal ve fiziksel niteliklerini taşıyan en küçük yapı taşıdır. Atom Yunancada "bölünemez" anlamına gelen "atomos"tan türemiştir. Atomus sözcüğünü ortaya atan ilk kişi MÖ 440'lı yıllarda yaşamış Demokritos'tur. Gözle görülmesi imkânsız, çok küçük bir parçacıktır ve sadece taramalı tünelleme mikroskobu vb. ile incelenebilir. Bir atomda, çekirdeği saran negatif yüklü bir elektron bulutu vardır. Çekirdek ise pozitif yüklü protonlar ve yüksüz nötronlardan oluşur. Atomdaki proton sayısı elektron sayısına eşit olduğunda atom elektriksel olarak yüksüzdür. Elektron ve proton sayıları eşit değilse bu parçacık iyon olarak adlandırılır. İyonlar oldukça kararsız yapılardır ve yüksek enerjilerinden kurtulmak için ortamdaki başka iyon ve atomlarla etkileşime girerler.

Elektron dizilimi, atom fiziği ve kuantum kimyasında, bir atom ya da molekülün elektronlarının atomik ya da moleküler orbitallerdeki dağılımıdır. Örneğin Neon atomunun elektron dizilimi 1s2 2s2 2p6 olarak gösterilir.

Geçiş metalleri veya bazı kimyacıların tabiriyle ağır metaller; sertlikleri, yüksek yoğunlukları, iyi ısı iletkenlikleri ve yüksek erime-kaynama sıcaklıklarıyla tanınırlar. Özellikle sertlikleri nedeniyle saf halde ya da alaşım halinde yapı malzemesi olarak kullanılırlar.

İterbiyum (Yb), sembolü ile bilinen, elektron dizilişlerinde f orbitalinde elektron barındıran kimyasal bir element. Bu element grup 3 elementlerine ve 6. periyot elementlerine ait olan bir lantanittir.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.

Manyetizma, manyetik alan tarafından oluşturulan fiziksel bir olgudur. Elektrik akımı ya da temel bir parçacık herhangi bir manyetik alan yaratabilir. Bu manyetik alan aynı zamanda diğer akımları ve manyetik momentleri de etkiler. Manyetik alan her maddeyi belli bir ölçüde etkiler. Kalıcı mıknatıslar üzerindeki etkisi en çok bilinen bir durumdur. Kalıcı mıknatıslar ferromanyetizmadan dolayı kalıcı manyetik momente sahiptir. Ferromanyetizma kelimesinde yer alan “ferro” ön eki demir elementinin isminden türetilmiştir. Çünkü kalıcı mıknatıs ilk olarak “manyetit – Fe3O4” adı verilen demir elementinin doğal bir formu olarak gözlemlenmiştir. Çoğu madde kalıcı momente sahip değildir. Bazıları manyetik alan tarafından çekilirken (paramanyetizm); bazıları manyetik alan tarafından itilir (diyamanyetizm). Bazıları ise herhangi bir manyetik alana maruz kaldığında daha karmaşık durumlara sevk olur. Manyetik alan tarafından ihmal edilecek ölçüde etkilenen maddeler ise manyetik olmayan maddeler olarak bilinir. Bunlar bakır, alüminyum, gazlar ve plastiktir. Ayrıca, saf oksijen sıvı hale kadar soğutulduğunda manyetik özellikler gösterir.
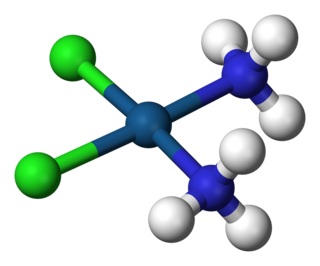
Kompleks, merkez atom olarak bir ya da birden fazla metal atomu veya iyonu ve metale bağlı ligandlardan oluşan yapıdır. Ligand, metale elektron vererek kompleks oluşturur. Metal içeren bileşiklerin birçoğu, özellikle geçiş metalleri içerenler koordinasyon bileşikleridir.

Floresans, soğuk cisimlerde moleküler fotonun yutulmasının daha uzun bir dalga boyunda diğer bir fotonun yayılmasını tetiklemesiyle gerçekleşen ışık verme (ışıma) olayıdır. Yutulan ve yayılan fotonlar arasındaki enerji farkı moleküler titreşimler ya da ısı olarak ortaya çıkar.
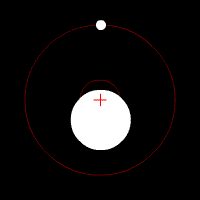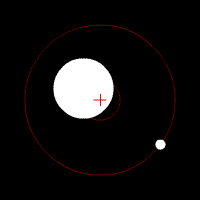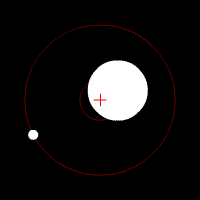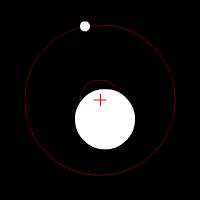
Yörünge periyodu, yörünge süresi veya orbital periyot, astronomik bir cismin yörüngesini tamamlaması için gereken süredir.

Hohmann transfer yörüngesi, bir uzay gemisindeki motorların belli bir süre yakılmasıyla aynı düzlem üstünde olan bir orbitten diğerine geçişdir. 1925'te Alman fizikçi, Walter Hohmann tarafından bulunmuştur.
Molekül fiziği ya da moleküler fizik, moleküllerin fiziksel özelliklerini ve molekülleri oluşturan atomlar arasındaki kimyasal bağları çalışan fizik dalıdır. En çok kullanılan deneysel teknikler spektroskopik tekniklerdir. Atomik fizik ile yakından ilgilidir ve ayrıca teorik kimya, fiziksel kimya ve kimyasal fizik ile çakışmaktadır. Ayrıca atom fiziğinde geçen atomik orbital teorisi, moleküler fizikte moleküler orbital teorisine genişlemektedir.
Moleküler orbital teorisi, atomik orbitallerin birbirleri ile etkileşimlerini ve bunun sonucu olarak molekül orbitallerin oluşumu üzerine kurulan ve özellikle kovalent bağları açıklamada oldukça başarılı olan bir teoridir. Kuantum fiziğinden yararlanarak orbitallerin hangi durumlarda bağ oluşturacaklarını veya oluşturamayacaklarını açıklamaya çalışır.
Kuantum mekaniğine göre atomik orbital, elektronların atom çekirdeği etrafındaki konumunu ve dalga-benzeri özelliklerini tanımlayan bir matematiksel fonksiyondur. Elektronun atom çekirdeği etrafındaki belirli bir bölgede bulunma olasılığı bu fonksiyon aracılığı ile hesaplanabilir. Fizikte atomik, kimyada orbital olarak geçer.

Baş kuantum sayısı, "n" ile gösterilen yörünge numarasının değerini belirleyen sayıdır. 1, 2, 3, 4, ... gibi sayı değerlerini alabilir. Yörünge numarası ile yörüngenin çekirdeğe uzaklığı doğru orantılıdır.
Robert Sanderson Mulliken moleküler orbital kuramının, başka bir deyişle moleküllerin yapısının hesaplanmasının moleküler orbital yöntemiyle detaylandırılması, gelişmesini sağlayan Amerikalı fizikçi ve kimyacı. Dr Mulliken 1966 yılında kimya dalında Nobel Ödülü'nü almıştır. 1983 yılında ise Priestley Madalyasını almıştır.
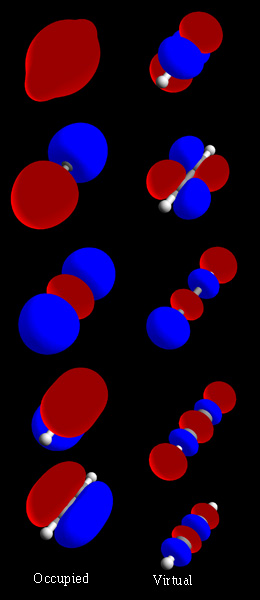
Kimyada moleküler orbital, bir molekül içindeki elektronların dalga benzeri davranışını tanımlayan matematiksel işlevdir. Molekülün herhangi bir bölümünde bir elektron bulma olasılığı gibi kimyasal ve fiziksel özellikleri hesaplamaya yarar.
"World in My Eyes", Depeche Mode'in ikinci albümü Violator'tan bir şarkı.
Blok, elementlerin, değerlik orbitallerinin türüne göre gruplandığı periyodik tablo kısımlarıdır. Değerlik orbital türleri olan s, p, d ve f; periyodik tablodaki bloklara da kendi isimlerini vermiştir ve dolayısıyla periyodik tablo; s bloku, p bloku, d bloku ve f bloku olmak üzere dört bloktan oluşmaktadır. Bunlara ek olarak, hipotetik bir g bloku kavramı da vardır. Kavramı ilk olarak Charles Janet, nappe kelimesiyle ifade etmiştir.

Avrupa E-yolu E15, Uluslararası E-yolu ağının bir parçasıdır. Inverness, İskoçya'nın güneyinden İngiltere'ye ve Fransa'dan İspanya'ya kadar uzanan kuzey-güney yolu. Uzunluğu 2.300 mil (3.700 km) 'dir.
Teorik kimya, kimyaya dair teorik genellemeler geliştiren bir kimya branşıdır. Teorik kimya kapsamında kimyasal bağlanma, kimyasal reaksiyonlar, değerlik, potansiyel enerji yüzeyi, moleküler orbitaller, orbital etkileşimleri gibi konular üzerine teoriler geliştirilmektedir.











