Periyodik tablo, kimyasal elementlerin sınıflandırılması için geliştirilmiş tablodur. Dilimizde periyodik tablo, periyodik cetvel, periyodik çizelge, elementler tablosu gibi birçok şekilde isimlendirilmiştir. Bu tablo bilinen bütün elementlerin artan atom numaralarına göre sıralanışıdır. Periyodik cetvelden önce de bu yönde çalışmalar yapılmış olmakla birlikte, mucidi genelde Rus kimyager Dmitri Mendeleyev kabul edilir. 1869'da Mendeleyev atomları artan atom ağırlığına göre sıraladığında belli özelliklerin tekrarlandığını fark etti. Özellikleri tekrarlanan elementleri alt alta yerleştirdi ve buna grup adını verdi.

Atom veya ögecik, bilinen evrendeki tüm maddenin kimyasal ve fiziksel niteliklerini taşıyan en küçük yapı taşıdır. Atom Yunancada "bölünemez" anlamına gelen "atomos"tan türemiştir. Atomus sözcüğünü ortaya atan ilk kişi MÖ 440'lı yıllarda yaşamış Demokritos'tur. Gözle görülmesi imkânsız, çok küçük bir parçacıktır ve sadece taramalı tünelleme mikroskobu vb. ile incelenebilir. Bir atomda, çekirdeği saran negatif yüklü bir elektron bulutu vardır. Çekirdek ise pozitif yüklü protonlar ve yüksüz nötronlardan oluşur. Atomdaki proton sayısı elektron sayısına eşit olduğunda atom elektriksel olarak yüksüzdür. Elektron ve proton sayıları eşit değilse bu parçacık iyon olarak adlandırılır. İyonlar oldukça kararsız yapılardır ve yüksek enerjilerinden kurtulmak için ortamdaki başka iyon ve atomlarla etkileşime girerler.
Fermiyon, parçacık fiziğinde, Fermi-Dirac istatistiğine uyan parçacıktır. Başka bir deyişle, Enrico Fermi ve Paul Dirac'ın gösterdiği üzere, Bose-Einstein istatistiğine sahip bozonların aksine fermiyonlar, belirtilen zamanda sadece bir kuantum durumuna karşılık gelebilen parçacıklardır. Eğer iki ayrı fermiyon uzayda aynı yerde tanımlanmışsa her bir fermiyonun özelliği birbirinden farklı olmak zorundadır. Örnek olarak, iki elektron bir çekirdeğin etrafında aynı orbitalde bulunacaklarsa, bu kez aynı spin durumunda olamazlar ve her orbitalde elektronun biri yukarı diğeri aşağı spin durumundadır.

Helyum, sembolü He ve atom numarası 2 olan kimyasal element. Periyodik cetvelin birinci periyot 8A grubunda yer alan bir gazdır. Kokusuz, renksiz bir gazdır ve yanmaz.
Elektron, eksi bir temel elektrik yüküne sahip bir atomaltı parçacıktır. Lepton parçacık ailesinin ilk nesline aittir ve bileşenleri ya da bilinen bir alt yapıları olmadığından genellikle temel parçacıklar olarak düşünülürler. Kütleleri, protonların yaklaşık olarak 1/1836'sı kadardır. Kuantum mekaniği özellikleri arasında, indirgenmiş Planck sabiti (ħ) biriminde ifade edilen, yarım tam sayı değerinde içsel bir açısal momentum (spin) vardır. Fermiyon olmasından ötürü, Pauli dışarlama ilkesi gereğince iki elektron aynı kuantum durumunda bulunamaz. Temel parçacıkların tamamı gibi hem parçacık hem dalga özelliklerini gösterir ve bu sayede diğer parçacıklarla çarpışabilir ya da kırınabilirler.

Elektron dizilimi, atom fiziği ve kuantum kimyasında, bir atom ya da molekülün elektronlarının atomik ya da moleküler orbitallerdeki dağılımıdır. Örneğin Neon atomunun elektron dizilimi 1s2 2s2 2p6 olarak gösterilir.
Alkali metaller periyodik tablonun birinci grubunda yer alan metallerdir. Fransiyum dışında hepsi, yumuşak yapıda ve parlak görünümdedir.
Yarı iletken üzerine yapılan mekanik işin etkisiyle iletken özelliği kazanabilen, normal şartlar altında yalıtkan olan maddelerdir.
Pauli dışarlama ilkesi ya da Pauli dışlama ilkesi, iki ya da daha çok özdeş fermiyonun aynı kuantum durumda olamayacağını belirten bir kuantum mekaniği yasasıdır. Bu yasa, kuramsal fizikçi Wolfgang Pauli tarafından 1925 yılında bulunmuştur. İlk bulunuşunda yasa yalnızca elektronlar için geçerliyken, 1940 yılında Spin-istatistik teoreminin bulunmasıyla birlikte bütün fermiyonları kapsayacak biçimde genişletilmiştir.

Elektrik akımı, elektriksel akım veya cereyan, en kısa tanımıyla elektriksel yük taşıyan parçacıkların hareketidir. Bu yük genellikle elektrik devrelerindeki kabloların içerisinde hareket eden elektronlar tarafından taşınmaktadır. Ayrıca, elektrolit içerisindeki iyonlar tarafından ya da plazma içindeki hem iyonlar hem de elektronlar tarafından taşınabilmektedir.

Molekül, birbirine bağlı gruplar halindeki atomların oluşturduğu kimyasal bileşiklerin en küçük temel yapısına verilen addır. Diğer bir ifadeyle bir molekül bir bileşiği oluşturan atomların eşit oranlarda bulunduğu en küçük birimdir. Moleküller yapılarında birden fazla atom içerirler. Bir molekül aynı iki atomun bağlanması sonucu ya da farklı sayılarda farklı atomların bağlanması sonucunda oluşabilirler. Bir su molekülü 3 atomdan oluşur; iki hidrojen ve bir oksijen. Bir hidrojen peroksit molekülü iki hidrojen ve 2 oksijen atomundan oluşur. Diğer taraftan bir kan proteini olan gamma globulin 1996 sayıda atomdan oluşmakla birlikte sadece 4 çeşit farklı atom içerir; hidrojen, karbon, oksijen ve nitrojen. Molekülleri oluşturan kimyasal bağlara Moleküler bağlar denir. Bunlar kovalent, iyonik ve metalik bağlardır.

İyon ya da yerdeş, bir veya daha çok elektron kazanmış ya da yitirmiş bir atomdan oluşmuş elektrik yüklü parçacıktır. Atomlar kararsız yapılarından kurtulmak ve kararlı hale gelebilmek için elektron alırlar ya da kaybederler. Bunun için de başka bir atomla ya da kökle bağ kurarlar.
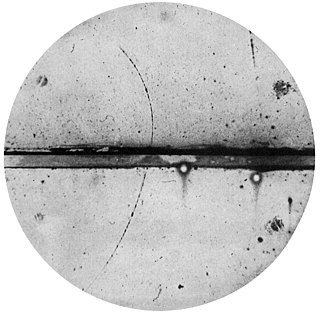
Pozitron, elektronun karşı parçacığı olan artı yüklü leptondur.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.

Atom çekirdeği, atomun merkezinde yer alan, proton ve nötronlardan oluşan küçük ve yoğun bir bölgedir. Atom çekirdeği 1911 yılında Ernest Rutherford tarafından keşfedildi. Bu keşif, 1909 yılında gerçekleştirilen Geiger-Marsden deneyine dayanmaktadır. Nötronun James Chadwick aracılığıyla 1932 yılında keşfinden sonra, çekirdeğin proton ve nötronlardan oluştuğu modeli Dmitri Ivanenko ve Werner Heisenberg tarafından çabucak geliştirildi. Atomun kütlesinin neredeyse tamamı çekirdek içerisindedir, elektron bulutunun atom kütlesine katkısı oldukça azdır. Proton ve nötronlar çekirdek kuvveti tarafından çekirdeği oluşturmak için birbirlerine bağlanmıştır.

Manyetizma, manyetik alan tarafından oluşturulan fiziksel bir olgudur. Elektrik akımı ya da temel bir parçacık herhangi bir manyetik alan yaratabilir. Bu manyetik alan aynı zamanda diğer akımları ve manyetik momentleri de etkiler. Manyetik alan her maddeyi belli bir ölçüde etkiler. Kalıcı mıknatıslar üzerindeki etkisi en çok bilinen bir durumdur. Kalıcı mıknatıslar ferromanyetizmadan dolayı kalıcı manyetik momente sahiptir. Ferromanyetizma kelimesinde yer alan “ferro” ön eki demir elementinin isminden türetilmiştir. Çünkü kalıcı mıknatıs ilk olarak “manyetit – Fe3O4” adı verilen demir elementinin doğal bir formu olarak gözlemlenmiştir. Çoğu madde kalıcı momente sahip değildir. Bazıları manyetik alan tarafından çekilirken (paramanyetizm); bazıları manyetik alan tarafından itilir (diyamanyetizm). Bazıları ise herhangi bir manyetik alana maruz kaldığında daha karmaşık durumlara sevk olur. Manyetik alan tarafından ihmal edilecek ölçüde etkilenen maddeler ise manyetik olmayan maddeler olarak bilinir. Bunlar bakır, alüminyum, gazlar ve plastiktir. Ayrıca, saf oksijen sıvı hale kadar soğutulduğunda manyetik özellikler gösterir.

Enerji seviyesi, atom çekirdeğinin etrafında katman katman biçiminde bulunan kısımların her biridir. Bu yörüngelerde elektronlar bulunur. Yörüngenin numarası; 1, 2, 3, 4, ... gibi sayı değerlerini alabilir. Yörünge numarasına baş kuantum sayısı da denir ve "n" ile gösterilir. Yörünge numarası ile yörüngenin çekirdeğe uzaklığı doğru orantılıdır.
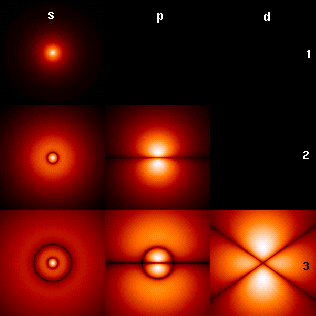
Kuantum mekaniğine göre atomik orbital, elektronların atom çekirdeği etrafındaki konumunu ve dalga-benzeri özelliklerini tanımlayan bir matematiksel fonksiyondur. Elektronun atom çekirdeği etrafındaki belirli bir bölgede bulunma olasılığı bu fonksiyon aracılığı ile hesaplanabilir. Fizikte atomik, kimyada orbital olarak geçer.
Değerlik kabuğu elektron çifti itmesi kuralları moleküllerin şekillerini tahmin etmede kullanılır ve değerlik elektron çiftlerinin birbirlerini elektrostatik kuvvetle itmesi temeline dayanır. Teorinin yaratıcısı olan bilim adamlarına atfen Gillespie–Nyholm teorisi olarak da adlandırılır. "VSEPR" kısaltması kimi zaman "vespır" olarak da telaffuz edilebilir.
Teoriye göre atomları çevreleyen değerlik elektron çiftleri birbirlerini iterek aralarındaki itme kuvvetini en aza indirirler ve böylece moleküle şeklini verirler. Merkez atoma bağlı atomların sayısı ile bağ yapmamış elektron çiftlerinin sayısının toplamı sterik numarayı verir.

Arthur Bruce McDonald, Kanadalı astrofizikçi. McDonald Sudbury Nötrino Gözlemevi Enstitüsü direktörü ve Kingston, Ontario'da bulunan Queen Üniversitesi'nde parçacık astrofiziği dalında Gordon ve Patricia Gray Kürsüsü başkanıdır. Japon fizikçi Takaaki Kajita ile ortaklaşa 2015 Nobel Fizik Ödülü'ne layık görülmüştür.