
Sodyum, periyodik cetvelde Na simgesi ile gösterilen ve atom numarası 11 olan element. Sodyum yumuşak ve kaygan bir metal olup alkali metaller grubuna aittir. Doğal bileşiklerin içinde bol miktarda bulunur. Yüksek oranda reaktiftir, sarı bir alevle yanar, su ile şiddetli reaksiyon verir ve havada hızla oksitlenir. Dolayısıyla, vazelin, gazyağı gibi hava ve su ile temasını kesecek bir ortamda saklanması gerekir.

Potasyum, bir kimyasal elementtir. Simgesi K ve atom numarası 19 dur. Potasyum adını izole edildiği Potas olarak da bilinen potasyum karbonattan almıştır. Potasyum yumuşak, gümüş-beyaz renkli alkali bir metaldir. Doğada deniz suyunda ve pek çok mineralde diğer elementlere bağlı olarak bulunur. Havada hızla oksitlenir ve suya karşı da çok aktiftir. Potasyum, pek çok açıdan sodyuma kimyasal olarak benzese de yaşayan organizmalarda, özellikle de hayvan hücrelerinde, sodyumdan farklı muamele görür. Kandaki seviyesinin düşük olmasına hipokalemi, yüksek olmasına hiperkalemi denir.

Gümüş, elementlerin periyodik tablosunda simgesi Ag olan, beyaz, parlak, değerli bir metalik element. Atom numarası 47, atom ağırlığı 107,87 gramdır. Erime noktası 961,9 °C, kaynama noktası 1950 °C ve özgül ağırlığı da 10,5 g/cm³'tür. Çoğu bileşiklerinde +1 değerliklidir. Günümüzde Dünya'da 55 yıllık gümüş rezervi kaldığı tahmin ediliyor. Yeni gümüş rezervleri keşfedilmezse 2078 yılında Dünya'daki gümüş rezervlerinin tükenebileceği tahmin ediliyor. En çok gümüş üretimi yapan ülkeler Meksika, Çin, Peru Şili ve Avustralya'dır.

Gübre, bitkinin beslenmesinde gerekli olan kimyasal elementleri sağlamak için toprağa ilave edilen herhangi bir madde.

Klor, VIIA grubunda bulunan hafif, keskin kokulu, yeşilimsi sarı renkli, tahriş edici ve zehirleyici bir gaz. Havadan 2,5 kat ağır olan klor ilk zamanlar bir bileşik olarak kabul ediliyordu. Klor ilk olarak 1774 yılında Carl Wilhelm Scheele tarafından keşfedildi. 1810 yılında ise bugünkü ismi Humphry Davy tarafından verildi.

Azot ya da nitrojen, simgesi N olan bir element olup atom numarası 7'dir. Renksiz, kokusuz, tatsız ve inert bir gazdır. Azot, dünya atmosferinin yaklaşık %78'ini oluşturur ve tüm canlı dokularında bulunur. Azot ayrıca, amino asit, amonyak, nitrik asit ve siyanür gibi önemli bileşikler de oluşturur.

Potasyum nitrat, formülü KNO3 olan bir potasyum bileşiğidir. Güherçile olarak da bilinen bileşik doğal hâlde kayaçlarda ve mağaralarda oluşan beyaz renkli kabuksu yapıda bulunur.

Kimyasal bileşik, kimyasal bağlarla bir arada tutulan birden fazla kimyasal elementin atomlarını içeren birçok özdeş molekülden oluşan kimyasal maddedir. Dolayısıyla tek bir elementin atomlarından oluşan bir molekül bileşik değildir. Bir bileşik, diğer maddelerle etkileşimi içerebilen kimyasal reaksiyonla farklı bir maddeye dönüştürülebilir. Bu süreçte atomlar arasındaki bağlar kırılabilir ve/veya yeni bağlar oluşabilir.

Sodyum perklorat formülü NaClO4 olan bir kimyasal bileşiktir. Perklorik asitin sodyum tuzu olan bu bileşik diğer perkloratlar gibi kuvvetli bir oksitleyicidir. Sodyum perkloratın çözünürlüğü diğer perklorat tuzları içinde en yüksek olanıdır. Beyaz kristallerden oluşan ve higroskopik özellikte olan sodyum perklorat suda ve alkolde oldukça çok çözünür. Genellikle monohidrat form halinde bulunur ve rombik bir kristal yapısına sahiptir. Standart oluşum entalpisi −382.75 kJ mol−1 dir.

Potasyum ferrosiyanür formülü K4[Fe(CN)6] • 3H2O olan bir kimyasal bileşiktir. Potasyum ferrosiyanür metal kompleks bileşiğinin [Fe(CN)6]4− potasyum tuzudur. Bu tuz limon sarısı monoklinik kristallerden oluşmuştur.

Potasyum kromat, kimyasal formülü K2CrO4 olan inorganik bir bileşiktir. Bu sarı katı madde, kromat anyonunun potasyum tuzudur. Sodyum kromat endüstriyel öneme sahip iken potasyum kromat daha çok laboratuvarlarda kullanılır. Potasyum kromat, kanserojen sınıfında bir madde olup kategori 2 kapsamında değerlendirilmektedir.
Halojenür, bir kısmı halojen atom diğer kısmı ise halojenden daha az elektronegatif radikal veya element olan ikili bileşik. Uygun koşullar altında alkali metalleri halojenler ile direkt birleşerek genel formülü MX(X = F, Cl, Br veya I) olan halojenürleri oluştururlar. Çoğu tuz halojenürdür. Oda sıcaklığında bütün alkali metalleri beyaz katı halinde halojenürler oluştururlar.

Kalay(II) klorür ya da stanit klorür, SnCl2 formülüne sahip, beyaz kristal halinde bir katıdır. Kararlı bir dihidrat oluşturur, ancak sulu çözeltileri, özellikle sıcaksa, hidrolize uğrama eğilimindedir. SnCl2 yaygın bir şekilde indirgeyici madde (bir asit çözeltisi içinde) olarak ve kalay kaplamada elektrolitik banyolarda kullanılır. Kalay (II) klorür, diğer kalay klorür (kalay(IV) klorür (SnCl4) ile karıştırılmamalıdır.

İyodik asit, HIO3, beyaz veya kirli beyaz bir katı madde olarak elde edilebilir. Suda çok iyi çözünür, ancak klorik asit veya bromik asidin aksine saf halde bulunur. İyodik asit +5 oksidasyon durumunda iyot içerir ve halojenlerin saf halde en stabil okso-asitlerinden biridir. İyot asidi dikkatle ısıtıldığında pentoksit iyice dehidre olur. Daha sonraki ısıtmada, iyot pentoksit ayrıca iyot, oksijen ve düşük iyot oksitleri karışımı vererek ayrışır.

Kloroplatinik asit (hekzakloroplatinik asit olarak da bilinir), [H3O]2[PtCl6](H2O)x (0≤x≤6) formülüne sahip bir inorganik bileşiktir. Kırmızı bir katı, genellikle sulu bir çözelti olarak önemli bir platin kaynağıdır. Genellikle kısaca H2PtCl6 olarak yazılsa da, hekzakloroplatinat anyonunun (PtCl62-) hidronyum (H3O+) tuzudur. Hekzakloroplatinik asit oldukça higroskopiktir.

Buz çözme, yani diğer adıyla anti Icıng yüzeydeki kar, buz veya donu temizleme işlemidir. Buzlanmayı önleme, sadece buzdan arınmakla kalmayan, aynı zamanda yüzeyde kalan ve belirli bir süre boyunca buzun yeniden oluşmasını geciktiren veya mekanik olarak çıkarmayı kolaylaştırmak için buzun yüzeye yapışmasını önleyen kimyasal maddelerin uygulanmasıdır.

Sodyum klorür, yaygın olarak 'tuz' ismiyle bilinen kimyasal formülü NaCl; 1/1 oranında sodyum ve klorür iyonları olan iyonik bileşik. Molar kütleleri sırasıyla 22.99 ve 35.45 g/moldur. 100 g NaCl, 39.34 g Na ve 60.66 g Cl içerir. Sodyum klorür, deniz suyunun tuzluluğundan ve birçok çok hücreli organizmanın hücre dışı sıvısından en çok sorumlu olan tuzdur. Yenilebilir sofra tuzu biçiminde yaygın olarak bir çeşni ve gıda koruyucusu olarak kullanılır. Birçok endüstriyel proseste büyük miktarlarda sodyum klorür kullanılır ve daha ileri kimyasal sentezler için hammadde olarak kullanılan sodyum ve klor bileşiklerinin ana kaynağıdır. Sodyum klorürün ikinci bir ana uygulaması donma sıcaklığı altındaki havalarda yolların buzunun çözülmesidir.

Otopsi kimyası, nekrokimya veya ölüm kimyası, ölü bir organizmanın kimyasal yapılarının, reaksiyonlarının, süreçlerinin ve parametrelerinin araştırıldığı bir kimya alt disiplinidir. Ölüm sonrası kimya, adli patolojide önemli bir rol oynar. Camsı sıvı, beyin omurilik sıvısı, kan ve idrarın biyokimyasal analizleri ölüm nedeninin belirlenmesinde veya adli vakaların aydınlatılmasında önemlidir.
Demir (III) klorür FeCl
3 formüllü inorganik bir bileşiktir. Kristal bir katı olmasının yanı sıra görüş açısına bağlı olarak farklı renklerle gözlemlenebilir; koyu yeşil, mor-kırmızı. Sulu formu da katı formu da fiziksel görünüm olarak koyu kahverengi rengindedir.
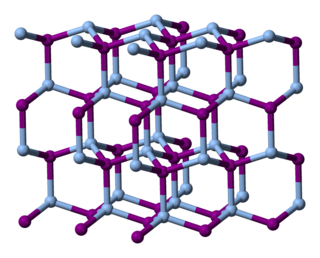
Gümüş iyodür, AgI formülüne sahip bir inorganik bileşiktir. Bileşik parlak sarı bir katıdır, ancak numuneler neredeyse her zaman gri bir renk veren metalik gümüş safsızlıkları içerir. Gümüş bulaşması, AgI'nin yüksek düzeyde ışığa duyarlı olması nedeniyle ortaya çıkar. Bu özellik gümüş esaslı fotoğrafçılık'ta kullanılır. Gümüş iyodür ayrıca antiseptik olarak ve bulut tohumlama için de kullanılır.


















