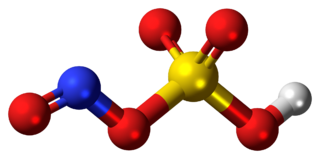
Nitro bileşiği

Nitro bileşikleri, bir veya daha fazla nitro fonksiyonel grubu (−NO2) içeren organik bileşiklerdir. Nitro grubu, dünya çapında kullanılan en yaygın eksplosoforlardan (bileşiği patlayıcı madde yapan fonksiyonel grup) biridir. Nitro grubuda güçlü bir elektron çeken gruptur. Bu özellik nedeniyle, nitro grubuna alfa (bitişik) olan C-H bağları asidik olabilir. Aynı nedenden dolayı, aromatik bileşiklerde nitro grubunun varlığı elektrofilik aromatik sübstitüsyonu yavaşlatsa da nükleofilik aromatik sübstitüsyonu kolaylaştırır. Nitro grupları, doğada nadiren bulunur ve nitrik asit ile başlayan nitrolama reaksiyonları tarafından neredeyse her zaman üretilir.
Sentezi
Aromatik nitro bileşiklerinin hazırlanması
Aromatik nitro bileşikleri tipik olarak nitrolama ile sentezlenir. Nitrolama, elektrofil nitronyum iyonu (NO2+) üreten bir nitrik asit ve sülfürik asit karışımı kullanılarak elde edilir:
 +
+ 
En büyük ölçekte üretilen nitrolama ürünü, en fazla nitrobenzendir. Trinitrofenol (pikrik asit), trinitrotoluen (TNT) ve trinitrorezorsinol (stifnik asit) dahil olmak üzere birçok patlayıcı madde nitrolama ile üretilir.[1] Halojenlenmiş fenollerden başlayan, aril-NO2 grubunun yapımı için bir başka ama daha özel bir yöntem, Zinke nitrolamasıdır.
Alifatik nitro bileşiklerinin hazırlanması
Alifatik nitro bileşikleri çeşitli yöntemlerle sentezlenebilir; önemli örnekler şunları içerir:
- Alkanların serbest radikal nitrolaması.[2] Reaksiyon, ana alkandan parçalar üretir ve farklı bir ürün karışımı oluşturur; örneğin, nitrometan, nitroetan, 1-nitropropan ve 2-nitropropan gaz fazında (örnk. 350-450 °C ve 8-12 atm) propanın nitrik asit ile reaksiyona sokulmasıyla üretilir.
- Gümüş veya alkali nitrit tuzları ile halokarbonlar[3] veya organosülfatlar[4] arasındaki nükleofil sübstitüsyon reaksiyonları.

- Nitrometan laboratuvarda sodyum kloroasetatın sodyum nitrit ile reaksiyona sokulmasıyla üretilebilir.[6]
- Oksimlerin[7] veya primer aminlerin[8] yükseltgenmesi.
- β-nitro alkollerin[9] veya nitroalkenlerin[10] indirgenmesi.
- Nitriller ve etil nitrattan[11][12] oluşan α-nitro karboksilik asitlerin dekarboksilasyonu ile.
Ter Meer Reaksiyonu
Nükleofilik alifatik sübstitüsyonda, sodyum nitrit (NaNO2) bir alkil halojenürle yer değiştirir. Adını Edmund ter Meer'den alan,[13] Ter Meer reaksiyonunda (1876), reaktant bir 1,1-halonitroalkandır:
İlk yavaş ilerleyen aşamada, bir protonun nitroalkan 1'den bir karbanyon 2'ye, ardından, bir aci-nitro 3'e protonasyona ve sonunda 3.3'ün deneysel olarak gözlemlenen hidrojenin kinetik izotop etkisine dayanarak, klorun nükleofilik yer değiştirmesinin önlendiği reaksiyon mekanizması önerilmektedir.[14] Aynı reaktant potasyum hidroksit ile reaksiyona girdiğinde, reaksiyon ürünü 1,2-dinitro dimerdir.[15]
Oluşumu
Doğada
Kloramfenikol, doğal yolla oluşan bir nitro bileşiğinin nadir örneğidir. En azından bazı doğal yolla oluşan nitro grupları, amino gruplarının oksidasyonu ile oluşur.[16] 2-Nitrofenol kenelerin toplanma feromonudur.
Nitro bileşiklerinin örnekleri doğada nadirdir. 3-Nitropropiyonik asit mantarlar ve bitkiler (Indigofera)de bulundu. Nitropentadesen, termitlerde bulunan bir savunma bileşiğidir. Nitrofeniletan Aniba canelilla'da bulunur.[17] Nitrofeniletan, Annonaceae, Lauraceae ve Papaveraceae üyelerinde de bulunur.[18]
Tıbbi ilaçlarda
Tıbbi ilaçlarda nadiren kullanılmasına rağmen, nitro grubu mutajenisite ve genotoksisite ile ilişkilidir ve bu nedenle genellikle ilaç keşfi sürecinde bir yükümlülük olarak görülür.[19]
Alifatik nitro bileşiklerinin reaksiyonları
İndirgenme
Nitro bileşikleri çeşitli organik reaksiyonlara katılır, en önemlisi, karşılık gelen aminlere indirgenmeleridir:
- RNO2 + 3 H2 → RNH2 + 2 H2O
Asit-baz reaksiyonları
Nitroalkanların α-karbonu biraz asidiktir. Nitrometan ve 2-nitropropanın pKa değerleri dimetil sülfoksit (DMSO) çözeltisinde sırasıyla 17.2 ve 16.9'dur. Bu değerler yaklaşık 11'lik bir sulu pKa'yı göstermektedir.[20] Başka bir ifadeyle, bu karbon asitler sulu çözelti içinde protondan arındırılabilir. Konjuge bazına nitronat denir. Nitronatlar, nitroaldol reaksiyonu ve Nef reaksiyonunda ara ürün olarak oluşurlar.
Kondensasyon reaksiyonları
Nitrometan, nitroaldol reaksiyonunda baz katalizatörü ile aldehitlere 1,2- konumunda eklenir. Benzer şekilde, Michael reaksiyonunda bir Michael vericisi olarak, alfa-beta doymamış karbonil bileşiklerine 1,4- konumunda eklenir. Nitroalkenler, enolat bileşikleri ile Michael reaksiyonunda Michael alıcılarıdır.[21][22]
Biyokimyasal reaksiyonlar
Birçok flavine bağımlı enzimler, alifatik nitro bileşiklerini daha az toksik aldehitler ve ketonlara yükseltgeyebilmektedirler. Nitroalkan oksidaz ve 3-nitropropiyonat oksidaz alifatik nitro bileşiklerini sadece yükseltgerken, glikoz oksidaz gibi diğer enzimlerin başka fizyolojik substratları da vardır.[23]
Aromatik nitro bileşiklerinin reaksiyonları
Aromatik nitro bileşiklerinin metal katalizörler aracılığıyla hidrojenle indirgenmesi anilinleri verir. Neredeyse tüm aromatik aminler (anilinler) nitroaromatiklerden türetilir. Bir farklılık, paladyumlu aktif karbon ve formaldehit aracılığıyla dimetilaminoaren oluşumudur:[24]
Leimgruber–Batcho, Bartoli ve Baeyer–Emmerling indol sentezleri aromatik nitro bileşikleri ile başlar. İndigo, Baeyer–Drewson indigo sentezi olarak bilinen bir reaksiyon kullanılarak kuvvetli bazik koşullarda orto-nitrobenzaldehit ve asetondan bir kondensasyon reaksiyonu yardımıyla sentezlenebilir.
Patlamalar
Organo nitro bileşiklerinin patlayıcı made olarak ayrışması hem oksitleyicinin (nitro grubu) hem de yakıtın (hidrokarbon yerine geçen) aynı molekül içinde bağlandığı redoks reaksiyonlarıdır. Patlama işlemi, moleküler azot (N2), karbon dioksit ve su dahil olmak üzere oldukça kararlı ürünler oluşturarak ısı üretir. Bu kararlı ürünler ılıman sıcaklıklarda gaz olduğu için, bu redoks reaksiyonunun patlayıcı gücü artar. Birçok temas patlayıcı maddeler nitro grubunu içerir.
Ayrıca bakınız
- Fonksiyonel grup
- Nitrit (bir NO2 grubu olsa da bağları farklı)
- Nitroalken
- Nitro bileşiklerinin indirgenmesi
- Nitrogliserin
- Nitrolama
Kaynakça
- ^ Gerald Booth, "Nitro Compounds, Aromatic", in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a17_411
- ^ Markofsky, Sheldon; Grace, W.G. (2000). Nitro Compounds, Aliphatic. Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a17_401. ISBN 978-3527306732.
- ^ Kornblum, N.; Ungnade, H. E. (1963). "1-Nitroöctane". Organic Syntheses. 4: 724. doi:10.15227/orgsyn.038.0075.
- ^ Walden, P. (1907). "Zur Darstellung aliphatischer Sulfocyanide, Cyanide und Nitrokörper". Berichte der Deutschen Chemischen Gesellschaft. 40 (3): 3214-3217. doi:10.1002/cber.19070400383. 9 Temmuz 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Temmuz 2020.
- ^ Olga V. Dorofeeva, Yuriy V. Vishnevskiy, Natalja Vogt, Jürgen Vogt, Lyudmila V. Khristenko, Sergey V. Krasnoshchekov, Igor F. Shishkov, István Hargittai, Lev V. Vilkov (2007). "Molecular Structure and Conformation of Nitrobenzene Reinvestigated by Combined Analysis of Gas-Phase Electron Diffraction, Rotational Constants, and Theoretical Calculations". Structural Chemistry. 18 (6): 739-753. doi:10.1007/s11224-007-9186-6.
- ^ Whitmore, F. C.; Whitmore, Marion G. (1923). "Nitromethane". Organic Syntheses. 1: 401. doi:10.15227/orgsyn.003.0083.
- ^ Olah, George A.; Ramaiah, Pichika; Chang-Soo, Lee; Prakash, Surya (1992). "Convenient Oxidation of Oximes to Nitro Compounds with Sodium Perborate in Glacial Acetic Acid". Synlett. 1992 (4): 337-339. doi:10.1055/s-1992-22006.
- ^ Ehud, Keinan; Yehuda, Mazur (1977). "Dry ozonation of amines. Conversion of primary amines to nitro compounds". The Journal of Organic Chemistry. 42 (5): 844-847. doi:10.1021/jo00425a017.
- ^ Chandrasekhar, S.; Shrinidhi, A. (2014). "Useful Extensions of the Henry Reaction: Expeditious Routes to Nitroalkanes and Nitroalkenes in Aqueous Media". Synthetic Communications. 44 (20): 3008-3018. doi:10.1080/00397911.2014.926373.
- ^ Shrinidhi, A. (2015). "Microwave-assisted chemoselective reduction of conjugated nitroalkenes to nitroalkanes with aqueous tri-n-butyltin hydride". Cogent Chemistry. 1 (1): 1061412. doi:10.1080/23312009.2015.1061412
 .
. - ^ Wislicenus, Wilhelm; Endres, Anton (1902). "Ueber Nitrirung mittels Aethylnitrat [Nitrification by means of ethyl nitrate]". Berichte der Deutschen Chemischen Gesellschaft. 35 (2): 1755-1762. doi:10.1002/cber.190203502106.
- ^ {{Kitap kaynağı|soyadı1=Weygand|ad1=Conrad|editör1-soyadı=Hilgetag|editör1-ad=G.|editör2-soyadı=Martini|editör2-ad=A.|başlık=Weygand/Hilgetag Preparative Organic Chemistry|url=https://archive.org/details/weygandhilgetagp00hilg%7Ctarih=1972%7Cyayıncı=John Wiley & Sons, Inc.|yer=New York|isbn=978-0471937494|sayfa=1007|basım=4.4
- ^ Edmund ter Meer (1876). "Ueber Dinitroverbindungen der Fettreihe". Justus Liebigs Annalen der Chemie. 181 (1): 1-22. doi:10.1002/jlac.18761810102.
- ^ Hawthorne, M. Frederick (1956). "Aci-Nitroalkanes. I. The Mechanism of the ter Meer Reaction1". Journal of the American Chemical Society. 78 (19): 4980-4984. doi:10.1021/ja01600a048.
- ^ 3-Hexene, 3,4-dinitro- D. E. Bisgrove, J. F. Brown, Jr., and L. B. Clapp. Organic Syntheses, Coll. Vol. 4, p.372 (1963); Vol. 37, p.23 (1957). (Article 12 Ocak 2011 tarihinde Wayback Machine sitesinde arşivlendi.)
- ^ Zocher, Georg; Winkler, Robert; Hertweck, Christian; Schulz, Georg E (2007). "Structure and Action of the N-oxygenase AurF from Streptomyces thioluteus". Journal of Molecular Biology. 373 (1): 65-74. doi:10.1016/j.jmb.2007.06.014. PMID 17765264.
- ^ José Guilherme S. Maia, Eloísa Helena A. Andrade "Database of the Amazon aromatic plants and their essential oils" Quim. Nova, (2009) 32(3), 595-622, 2009 [1] 23 Kasım 2015 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Klaus Kubitzki, Jens G. Rohwer, Volker Bittrich "Flowering Plants • Dicotyledons: Magnoliid, Hamamelid and Caryophyllid Families" 1993, Springer-Verlag, Berlin
- ^ Nepali K, Lee HY, Liou JP (Mart 2019). "Nitro-Group-Containing Drugs". J. Med. Chem. 62 (6): 2851-2893. doi:10.1021/acs.jmedchem.8b00147. PMID 30295477.
- ^ Bordwell, Frederick G; Satish, A. V (1994). "Is Resonance Important in Determining the Acidities of Weak Acids or the Homolytic Bond Dissociation Enthalpies (BDEs) of Their Acidic H-A Bonds?". Journal of the American Chemical Society. 116 (20): 8885. doi:10.1021/ja00099a004.
- ^ Ranganathan, Darshan; Rao, Bhushan; Ranganathan, Subramania; Mehrotra, Ashok; Iyengar, Radha (1980). "Nitroethylene: a stable, clean, and reactive agent for organic synthesis". The Journal of Organic Chemistry. 45 (7): 1185-1189. doi:10.1021/jo01295a003.
- ^ Jubert, Carole; Knochel, Paul (1992). "Preparation of polyfunctional nitro olefins and nitroalkanes using the copper-zinc reagents RCu(CN)ZnI". The Journal of Organic Chemistry. 57 (20): 5431-5438. doi:10.1021/jo00046a027.
- ^ Nagpal, Akanksha; Valley, Michael P.; Fitzpatrick, Paul F.; Orville, Allen M. (2006). "Crystal Structures of Nitroalkane Oxidase: Insights into the Reaction Mechanism from a Covalent Complex of the Flavoenzyme Trapped during Turnover". Biochemistry. 45 (4): 1138-50. doi:10.1021/bi051966w. PMC 1855086 $2. PMID 16430210.
- ^ Organic Syntheses, Coll. Vol. 5, p.552 (1973); Vol. 47, p.69 (1967). http://orgsynth.org/orgsyn/pdfs/CV5P0552.pdf 27 Temmuz 2011 tarihinde Wayback Machine sitesinde arşivlendi.