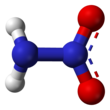
Guanin (IUPAC ID: 2-amino-1H-purin-6(9H)-one) DNA ve RNA nükleik asitlerinde bulunan molekül. Diğerleri sitozin, timin, adenin ve urasil olmak üzere beş asıl azotlu bazdan biridir. C5H5N5O formullü bir pürin türevi olan guanin, Watson-Crick baz eşleşmesinde sitozin ile 3'lü hidrojen bağı kurar. Çift bağlarla eşlenmiş bir pirimidin-imidiazol çember sistemi içerir ve doymamış bi-siklik hali düzlemseldir. Guanin nükleotitine guanozin denir.

Amino asitler, proteinleri oluşturan temel yapı taşlarıdır.

Brom (Br), Antoine Balard tarafından 1826 yılında keşfedilen halojen ametal. Yunanca dışkı gibi koku anlamındaki bromosdan gelmiştir.

Karbondioksit, kovalent bağlı bir karbon ve iki oksijen atomundan oluşan moleküle sahip, normal koşullarda gaz hâlinde bulunan bileşiğin adıdır. Renk ve kokusu yoktur. Kimyasal formülü CO2 şeklinde olup molekül ağırlığı 44,009 g/mol'dür. Karbon içeren besin maddelerinin metabolize edilmesi sonucu meydana gelen bir son üründür. Küresel ısınmada önemli bir pay sahibidir. Yerden yansıyan güneş ışınlarının atmosferden çıkma oranını azaltır.
Alkol, karbon atomuna doğrudan bir -OH (hidroksil) grubunun bağlı olduğu organik bileşiklere verilen genel ad. Genel formülü CnH2n+1OH olan mono alkoller, alkollerin önemli bir sınıfıdır. Bunlardan etanol (C2H5OH), alkollü içeceklerde bulunan türüdür. Genellikle alkol kelimesi ile etanol kastedilir ki yeni fermente olmuş birada etanol oranı %3-5 arasında iken şarapta %12-15 arasındadır.
Hidroliz işlemi suyu oluşturan hidrojen ve oksijen elementlerinin birbirinden ayrılması ile sonuçlanan bir işlemdir. Bazı kaynaklarda hidroliz, moleküllerin su ilavesiyle daha fazla sayıda parçacık oluşturması olarak da geçer. Hidroliz, su ile bir kimyasal bağın parçalanmasıdır yani bir kimyasal reaksiyondur. Hidroliz genel olarak suyun nükleofil olduğu ikame(yer değiştirme reaksiyonu), eliminasyon(organik reaksiyon türü) ve solvasyon (çözme) reaksiyonları için kullanılır.

'Adenozin trifosfat, hücre içinde bulunan çok işlevli bir nükleotittir. İngilizce Adenosine Triphosphateden ATP olarak kısaltılır. En önemli işlevi hücre içi biyokimyasal reaksiyonlar için gereken kimyasal enerjiyi taşımaktır. Fotosentez ve hücre solunumu sırasında oluşur. ATP bunun yanı sıra RNA sentezinde gereken dört monomerden biridir. Ayrıca ATP, hücre içi sinyal iletiminde protein kinaz reaksiyonu için gereken fosfatın kaynağıdır. 3 tane fosfattan oluşur.
Kimya ve biyokimyada, yağ asidi, genelde uzun, alifatik kuyruklu bir karboksilik asittir. Uzun karboksilik yağ asitlerinden 4 karbonlu ve daha uzun zincirlileri yağ asidi olarak sayılır; doğal yağları (trigliseritleri) oluşturan yağ asitlerinden söz ederken ise bunların en az 8 karbonlu olduğu varsayılabilir. Çoğu doğal yağ asitlerinin çift sayılı karbon atomu vardır, çünkü bunların biyolojik sentezlerinde iki karbon atomlu asetat kullanılır.

Karboksilik asitler karboksil grubu olan organik asitlerdir, -C(=O)OH formülüne sahiptirler, bu genelde -COOH veya CO2H olarak da yazılır. Karboksilik asitler Bronsted asitleridir, yani proton vericileridir. Karboksilik asitlerin tuz ve anyonlarına karboksilat denir. Karboksilik asitler, esterlerle fonsiyonel grup izomeridirler. Karboksilik asitlerin en basit dizisi alkanoik asitlerdir, R-COOH formülüyle gösterilirler, R bir hidrojen atomu veya bir alkil grubuna karşılık gelir. Bileşiklerde birden fazla karboksilik asit grubu bulunabilir.

Krebs döngüsü, trikarboksilik asit döngüsü veya sitrik asit döngüsü, canlı hücrelerin besinleri yükseltgeyerek enerji elde etmesini sağlayan ve bütün yaşam biçimlerinde önemli bir yer tutan kimyasal süreçlerin son aşamasıdır. TCA devri olarak da bilinir. 1937'de Hans Adolf Krebs tarafından açıklığa kavuşturulan tepkimelerin hayvan, bitki, mikroorganizma ve mantar gibi birçok hücre türünde oluştuğu saptanmıştır.
Nitrik asit, HNO3 kimyasal formülüne sahip oldukça aşındırıcı bir inorganik asittir. Kezzap olarak da bilinir. Saf hâldeki bileşik renksizdir. Ancak uzun süre bekleyen eski asitler azot oksitleri ve suya ayrışması nedeniyle sarı renge dönebilme özelliğindedirler. Piyasada bulunan nitrik asitlerin çoğu % 68'lik bir konsantrasyona sahiptir. Çözelti, %86'dan fazla HNO3 içerdiğinde, dumanlı nitrik asit olarak adlandırılır. Mevcut azot dioksit miktarına bağlı olarak, dumanlı nitrik asit ayrıca %86’nın üzerindeki konsantrasyonlarda kırmızı dumanlı nitrik asit veya %95’in üzerindeki konsantrasyonlarda beyaz dumanlı nitrik asit olarak tanımlanır.
Kimyasal sentez, birden fazla maddenin bir olayda kendi özelliklerini kaybedip yeni özellikte bir madde meydana getirmeleri olayı. Kimyasal sentez kimyasal ayrışmanın karşıtı bir olaydır. Kimyasal sentez olayına giren maddeler element veya bileşik halinde bulunabilirler.

Sodyum azotür, NaN3 formüllü inorganik bileşiktir. Bu renksiz tuz çoğu araba hava yastığı sisteminde kullanılan gaz oluşturucusudur. Diğer azotür bileşiklerinin hazırlanabilmesi için de kullanılır. İyonik bir maddede olan sodyum azotür, suda oldukça iyi çözünür ve güçlü bir toksiktir.

Arsenöz asit (veya arsenik oksit), H3AsO3 formülüne sahip bir inorganik bileşiktir. Sulu çözeltilerde meydana geldiği bilinmektedir, ancak bu gerçek As(OH)3'ün öneminden uzaklaşmasa da saf bir malzeme olarak izole edilmemiştir.
Permanganik asit, HMnO4 formülüne sahip bir inorganik bileşiktir. Bu güçlü oksoasit, dihidrat olarak izole edilmiştir. Permanganat tuzlarının konjugat asididir. Çok az sayıda yayın konusu olup, karakterizasyonu ve kullanımları çok sınırlıdır.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.
Nitrolama bir nitro grubunun organik kimyasal bileşik içine sokulması için genel bir kimyasal proses sınıfıdır. İfade daha genel olarak, ayrıca nitrogliserin sentezinde olduğu gibi alkoller ve nitrik asit arasında farklı nitrat esterleri oluşturma işlemine yanlış olarak uygulanır. Nitro bileşiklerinin ve nitratların ortaya çıkan yapısı arasındaki fark nitro bileşiklerindeki azot atomunun doğrudan oksijen olmayan bir atoma genel olarak da karbon veya başka azot atomuna bağlanmasıdır. Oysaki organik nitratlar olarak da adlandırılan nitrat esterlerinde, azot bir oksijen atomuna genellikle dolayısıyla da bir karbon atomu 'na bağlanır.
Biyosentez, substratların canlı organizmalarda daha karmaşık ürünlere dönüştürüldüğü çok aşamalı, enzim katalizli bir süreçtir. Biyosentezde basit bileşikler modifiye edilir, diğer bileşiklere dönüştürülür veya makromoleküller oluşturmak üzere birleştirilir. Bu süreç genellikle metabolik yollardan oluşur. Bu biyosentetik yollardan bazıları tek bir hücresel organel içinde yer alırken diğerleri birden fazla hücresel organel içinde yer alan enzimleri içerir. Bu biyosentetik yolların örnekleri arasında çift katlı lipit katmanının bileşenlerinin ve nükleotidlerin üretimi yer alır. Biyosentez genellikle anabolizma ile eş anlamlıdır ve bazı durumlarda birbirinin yerine kullanılır.
Metabolik atıklar veya dışkılar, metabolik süreçlerden arta kalan ve organizma tarafından kullanılamayan ve bu nedenle atılması gereken maddelerdir. Buna Azot bileşikleri, su, CO2, fosfatlar, sülfatlar vb. dahildir. Hayvanlar bu bileşikleri atık olarak ele alır. Bitkiler, bazılarını faydalı maddelere dönüştüren kimyasal "mekanizmalara" sahiptir.
Nitrometan, bazen basitçe "nitro" olarak adlandırılan ve kimyasal formülü CH3NO2 olan bir organik bileşiktir. En basit organik nitro bileşiğidir. Ekstraksiyonlar, reaksiyon ortamı ve temizleme solventi gibi çeşitli endüstriyel uygulamalarda çözücü olarak yaygın bir şekilde kullanılan polar bir sıvıdır. Organik sentezde bir ara ürün olarak pestisit, patlayıcı, lif ve kaplama üretiminde yaygın olarak kullanılır. Nitrometan çeşitli Tap Fuel kalkış yarışı gibi motor sporlarında ve Radyo-kontrollü uçaklarda, tel kumanda kontrollü ve serbest uçuş model uçaklardaki minyatür içten yanmalı motorlarda yakıt katkı maddesi olarak kullanılır.