Nükleofil yer değiştirme tepkimeleri
Nükleofil ismi, atomun artı kısmı manasına gelen nucleo ve Yunancada seven manasına gelen philos kelimelerinden oluşmaktadır. İsimden de anlaşılacağı gibi nükleofiller artı parçacıkları seven artı merkez arayışı içinde olan moleküllerdir. Bu tür tepkimelerde nükleofiller yani bir çift ortaklaşmamış elektrona sahip molekül, bir alkil halojenürün halojen kısmıyla yer değiştrir işte bu şekilde gerçekleşen yer değişikliklerine Nükleofil yer değiştirme tepkimeleri denir. Elektronegatif halojen elektronları kendine doğru çektiğinden dolayı Karbon otomu üzerinde kısmi bir pozitif yük oluşmuş oluyor. Bu tepkimede de görüldüğü gibi bir yer değiştirme işlemi vardır.
| Nükleofil yer değiştirmeyi gösteren genel bir şema. | ||||
 | ||||
| 1:Nükleofil 2:Alkil halojenür 3:Ürün 4:Halojenür iyonu | ||||
İşte yer değiştirme tepkimelerinde nükleofilin moleküle bağlanabilmesi için molekülün iyi bir ayrılan gruba sahip olası gerekmektedir. İste halojenür iyonlar nispeten kararlı ve hafif bazik özellik gösterdikleri için ayrılan gruplar olarak adlandırılırlar. Yani bir yer değiştirme tepkimesi sırasında ayrılan gruplar genellikle halojenürler olur. Yer değiştirme tepkimelerinde ayrılan grubu İngilizcede leaving kelimesinin ilk harfi kullanılarak basit bir yer değiştirmesi tepkimesi eşitliği yazılabilir.Nükleofiller en azından eşlenmemiş bir elektron çifti içeren negatif ya da Nötr olan parçacıklardır.[1]
| Nükleofil yer değiştirmeyi gösteren genel bir şema. | ||||
 | ||||
| 1:Nükleofil(Burada Nükleofil Nötr'dür.) 2:Alkil halojenür 3:Ürün 4:Halojenür iyonu | ||||
| Nükleofil yer değiştirmeyi gösteren genel bir şema. | ||||
 | ||||
| 1:Nükleofil(Burada Nükleofil Negatif'dir.) 2:Alkil halojenür 3:Ürün 4:Halojenür iyon | ||||
İşte bu örneklerde de görüldüğü gibi Nükleofil yer değiştirme tepkimelerinde moleküle yeni eklenen bir molekülün yanı sırına ayrılan bir grupta bulunmaktadır. İşte bu ayrılama ve eklenme ne zaman olmaktadır? Acaba bu iki işlem aynı anda mı gerçekleşmekte yoksa birisi diğerinden öncemi gerçekleşmektedir? Bunların yanı sıra tepkimenin hızını belirten basamak hangisidir? İşte bu tür sorulara cevap verebilmek için SN2 ve SN1 tepkimeleri diye adlandırılan Nükleofil yer değiştirme tepkimelerini yakından inceleyeceğiz.[2]
SN2 tepkimeleri
SN2 Tepkimesinin mekanizmasında nükleofil ayırlan kısmın zıt tarafında yani tam karşısından moleküle yaklaşır. Bu şekilde ayrılan grubu yapısında barındıran karbon atomu yaklaşan nükleofille zayıf bir bağ kurmaya başlar. Yani aynı zamanda hem ayrılan kısım hem de nükleofil karbon atomuna bağlıdırlar. Tepkime ilerledikçe karbon ve ayrılan kısım arasındaki bağ zayıflarken, karbon ve nükleofil arasındaki bağ ise güçlenmektedir. Tepkimelerin sonuna doğru karbon ve nükleofil arasındaki bağın güçlenmesi sonucunda ayrılan kısım karbon atomundan tamamen kopar. İşte nükleofil bağlanması ve ayrılan kısmın kopması işlemine geçil hali denilir ve bu arada bir ürün oluşmaz ve işlem çok hızlı bir şekilde gerçekleşmektedir. Geçil halinden hem nükleofilin hem de ayrılan kısmının yani her ikisinin aynı zamanda tepkimeye girmesinden dolayı SN2 tepkimeleri olarak adlandırılır.
| SN2 Tepkimelerini gösteren bir mekanizma | ||||
 | ||||
| 1:Nükleofil 2:Alkil halojenür (Sübstrat) 3: Geçiş hali 4:Ürün 5: Ayrılan kısım | ||||
Yukardaki tabeldada görüldüğü gibi Nükleofil yer değiştirme tepkimelerinde negatif olan hidroksil iyonu(1. ile gösterilmiştir) ein elektron çiftini positif olan karbon(2. ile gösterilmiştir) atomunu iter ve bu arada klor bir elektron çiftiyle beraber bağlı olduğu karbon atomundan ayrılmaya başlar. Tepkime geçiş haline (3. ile gösterilmiştir ) girmiştir. Burada oksijen karbon atomuna yarım bağlarla bağlanmış ve klorunda tam bağları zayıflayarak yarım bağ haline gelmiştir. Bu esnada karbon atomunun konfigrosyanı tersine dönmeye başlamıştır. Bu devre geçiş evresi olarak adlandırılıp ve çok hızlı bir şekilde gerçekleşmektedir. Tepkimenin ilerlemesi.[3]
SN1 Tepkimeleri
| SN1 Tepkimelerini gösteren bir mekanizma | ||||
 | ||||
| (1.basamağ) Bu basamak SN1 ilk basamağı olup çok yavaştır.Klorun atomunun molekülün yapısından ayrılmasıyla ilk ara ürün olan üçüncül karbokatyon oluşur. | ||||
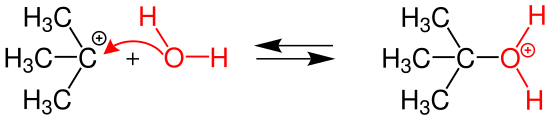 | ||||
| (2.basamağ) Bu basamak SN1 ikinci basamağı olup ilk basamaktan oldukça hızlıdır.Burada karbokatyonun yapısına bir su molekülün katılmasıyla ikinci ara ürün olan tert-bütiloksonyum iyonu oluşur. | ||||
 | ||||
| (3.basamağ) Bu basamak SN1 üçüncü basamağı olup ilk basamaktan oldukça hızlıdır.Burada bir Hidrojenin molekülden koparılmasıyla ana ürün olan tert-bütilalkol ve hidrojen iyonu oluşur. olıuşur. | ||||
Eğer bir tepkime birden fazla basamaktan oluşuyorsa bunun hızı tespit edilirken basamaklar arasındaki hız farkına bakılır. Şayet bir basamak diğerlerine göre çok yavaşsa tepkimenin hız belirleyici basamağı bu en yavaş olan basamağı baz alınır. Bu yavaş basamak genel itibarıyla tepkimenin hızını etkilediği için hız sınırlayıcı ya da hız belirleyici basamak olarak da adlandırılır. İşte SN1 tepkimeleri yukarıda tarif ettiğimiz tepkimelerin kategorisine girmektedir. Genel itibarıyla SN1 tepkimeleri 3 basamaktan oluşmakta ve bu basamaktan ilki 3 basamağın en yavaşı olup tepkimenin hızını belirleyen kısımdır.
Yandaki tabloda bir SN1 tepkimesinin basamaklarını görmekteyiz.
1.Basamakta klor ortamda bulunan polar çözücünün yardımıyla bir elektron çiftini de alarak bağlı olduğu karbondan ayrılması sonucunda ilk ara ürün olan karbokatyon oluşur ve bu basamak tepkimenin en yavaş basamağıdır.
2. Basamakta ise ortamda bulunan su molekülü karbokatyona bir elektron çifti vererek oksijen atomu üzerinden karbon atomuna bağlanır. Bu basamak genel itibarıyla üçüncü basamak gibi ilk basamaktan daha hızlı olup bu basamağın sonucunda ikinci ara ürünümüz olan ter-bütiloksonyum iyonu oluşur.
3.Basamakta yani son basamakta ter-bütiloksonyum iyonundan bir hidrojen iyonunun uzaklaşması sonucunda ana ürünümüz olan ter-bütilolkol ve ayrılan kısım olan hidrojen iyonu oluşmuş olur. Bu tepkime esnasında ana ürün oluşuncaya kadar iki farklı ara ürünün oluştuğunu görmekteyiz.
Burada ilk basamak diğer iki basamağa nazaran oldukça yavaş gerçekleşen bir basamaktır. Bu yüzden tepkimenin hızını belirleyen basamak tepkimenin ilk basamağıdır. Dikkat edilecek ikinci bir husus da tepkimenin hızının belirlendiği ilk basamakta sadece ayrılan kısım olan Klor tepkimede yer aldığı için bu tepkime SN1 tepkimesi olarak adlandırılır.[4]
Kaynakça
T.W Graham Solamons(Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, (Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0.
Harold Hart (Autor), Leslie E. Craine (Autor), David J. Hart (Autor), Christopher M. Hadad (Autor); Nicole Kindler (Übersetzer): Organische Chemie, 3. Auflage, Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8.
- ^ Harold Hart (Autor), Leslie E. Craine (Autor), David J. Hart (Autor), Christopher M. Hadad (Autor); Nicole Kindler (Übersetzer): Organische Chemie, 3. Auflage, Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31801-8, S. 226
- ^ T.W Graham Solamons( Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, ( Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 231-234
- ^ T.W Graham Solamons( Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, ( Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 235-236
- ^ T.W Graham Solamons( Yazar), Craig B. Fryhle (Yazar),Güral Okay (Çeviri Editörü), Yılmaz Yıldırır (Çeviri Editörü) Organik Kimya, ( Organik Chemsty), 7. Basımdan Çeviri, Literatür Yayıncılık 2002, ISBN 975-8431-87-0. Sayfa 243-245








