Nörofarmakoloji
Nörofarmakoloji, ilaçların sinir sistemindeki hücresel işlevini ve davranışı etkileyen nöral mekanizmaları araştıran bilim dalıdır.[1] Nörofarmakolojinin davranışsal ve moleküler olmak üzere iki ana alt dalı vardır. Davranışsal nörofarmakoloji, ilaç bağımlılığı ve bağımlılığının insan beynini nasıl etkilediğinin incelenmesi de dahil olmak üzere ilaçların insan davranışını nasıl etkilediğine (nöropsikofarmakoloji ) odaklanır.[2] Moleküler nörofarmakoloji, nöronların ve nörokimyasal etkileşimleri incelemenin yanı sıra nörolojik fonksiyon üzerinde faydalı etkileri olan ilaçların geliştirilmesi genel amacını taşır. Bu alanların her ikisi de yakından bağlantılıdır, çünkü her ikisi de merkezi ve periferik sinir sistemlerindeki nörotransmitterler, nöropeptitler, nörohormonlar, nöromodülatörler, enzimler, ikinci haberciler, ortak taşıyıcılar, iyon kanalları ve reseptör proteinlerinin etkileşimleri ile ilgilidir. Bu etkileşimleri inceleyen araştırmacılar, ağrı, Parkinson hastalığı ve Alzheimer hastalığı gibi nörodejeneratif hastalıklar, psikolojik bozukluklar, bağımlılık gibi birçok farklı nörolojik bozukluğu tedavi etmek için ilaçlar geliştirirler.
Tarihçe
Nörofarmakoloji, 20. yüzyılın başlarında, bilim adamları sinir sistemi ve sinirlerin birbirleri arasında nasıl iletişim kurduğuna dair temel bir anlayış bulana kadar bilimsel alanda ortaya çıkmadı. Bu keşiften önce, sinir sistemi üzerinde bir tür etki gösteren ilaçlar bulunmuştur. 1930'larda Fransız bilim adamları sıtmaya karşı savaşabilecek bir ilacı sentezleme umuduyla fenotiyazin adı verilen bir bileşikle çalışmaya başladı. Bu ilaç sıtma ile enfekte kişilere karşı kullanımda çok az umut gösterse de, Parkinson hastalığı olan hastalara yönelik faydalı etkiler ile birlikte yatıştırıcı etkilere sahip olduğu bulunmuştur. Bir araştırmacının bir ilacı uygulayacağı ve ilacın eylemini hasta tepkisiyle nasıl ilişkilendireceğini bilmeden yanıtı inceleyeceği bu kara kutu yöntemi, 1940'ların sonlarında ve 1950'lerin başında bilim adamları tespit edebilene kadar bu alana ana yaklaşımdı. norepinefrin (kan damarlarının daralmasına ve kalp hızı ve kan basıncındaki artışa dahil), dopamin (kıtlığı Parkinson hastalığına karışan kimyasal) ve serotonin (yakında depresyona derinden bağlı olarak tanınacak) gibi spesifik nörotransmitterler ). 1950'lerde bilim adamları, vücuttaki spesifik nörokimyasalların seviyelerini daha iyi ölçebildiler ve böylece bu seviyeleri davranışla ilişkilendirdiler.[3] 1949'da gerilim kelepçesinin icadı, iyon kanallarının ve sinir aksiyon potansiyelinin incelenmesine izin verdi. Nörofarmakolojideki bu iki önemli tarihsel olay, bilim insanlarının sadece bilginin bir nörondan diğerine nasıl aktarıldığını araştırmasını değil, aynı zamanda bir nöronun bu bilgiyi kendi içinde nasıl işlediğini de incelemesine izin verdi.
Genel bakış
Nörofarmakoloji, tek nöron manipülasyonundan beynin, omuriliğin ve periferik sinirlerin tüm alanlarına kadar sinir sisteminin birçok yönünü kapsayan çok geniş bir bilim dalıdır. İlaç geliştirmenin arkasındaki temeli daha iyi anlamak için önce nöronların birbirleriyle nasıl iletişim kurduğunu anlamak gerekir. Bu makale ilaç etkisi yoluyla manipüle edilen ana reseptörler, iyon kanalları ve nörotransmitterler ve nörolojik bozukluğu olan kişilerin bu ilaç etkisinden nasıl yararlandıkları gibi hem davranışsal hem de moleküler nörofarmakolojinin çalışma alanı olan konulara odaklanacaktır.
Nörokimyasal etkileşimler

Tıpta nörofarmakolojinin getirebileceği potansiyel gelişmeleri anlamak için, insan davranışı ve düşünce süreçlerinin nörondan nörona nasıl aktarıldığını ve ilaçların bu süreçlerin kimyasal temellerini nasıl değiştirebileceğini anlamak önemlidir.
Nöronlar uyarılabilir hücreler olarak bilinir, çünkü yüzey zarında, küçük yüklü parçacıkların hücreye girip çıkmasına izin veren iyon kanalları olarak bilinen çok sayıda protein vardır. Nöronun yapı, kimyasal bilgiler, tarafından alınan sağlar dendritler boyunca yayılan, perikaryonda (hücre gövdesi) ve onun aşağı akson ve sonunda kendi üzerinden diğer nöronlara geçen akson terminali . Bu voltaj kapılı iyon kanalları, hücre boyunca hızlı depolarizasyona izin verir. Bu depolarizasyon, belirli bir eşiğe ulaşırsa, bir aksiyon potansiyeline neden olacaktır. Aksiyon potansiyeli akson terminaline ulaştığında, hücreye kalsiyum iyonlarının akmasına neden olur. Kalsiyum iyonları daha sonra veziküllerin, nörotransmitterlerle dolu küçük paketlerin hücre zarına bağlanmasına ve içeriğini sinaps içine salmasına neden olur. Bu hücre pre-sinaptik nöron olarak bilinir ve salınan nörotransmitterlerle etkileşime giren hücre post-sinaptik nöron olarak bilinir. Nörotransmitter sinaps içine salındıktan sonra, ya sinaptik sonrası hücre üzerindeki reseptörlere bağlanabilir, pre-sinaptik hücre onu tekrar alabilir ve daha sonraki iletim için kaydedebilir ya da sinapstaki enzimler tarafından parçalanabilir belirli nörotransmittere özgüdür. Bu üç farklı eylem, ilaç etkisinin nöronlar arasındaki iletişimi etkileyebileceği ana alanlardır.[3]
Nörotransmitterlerin sinaptik sonrası bir nöron üzerinde etkileşime girdiği iki tip reseptör vardır. İlk reseptör tipleri, ligand kapılı iyon kanalları veya LGIC'lerdir. LGIC reseptörleri, kimyasal sinyalden elektrik sinyaline en hızlı iletim türüdür. Nörotransmitter reseptöre bağlandığında, iyonların doğrudan hücreye akmasına izin verecek konformasyonel bir değişikliğe neden olacaktır. İkinci tipler G-protein bağlı reseptörler veya GPCR'ler olarak bilinir. Hücre içinde gerçekleşmesi gereken biyokimyasal reaksiyonların miktarındaki artış nedeniyle bunlar LGIC'lerden çok daha yavaştır. Nörotransmitter GPCR proteinine bağlandıktan sonra, hücre biyokimyası, fizyolojisi ve gen ekspresyonunda birçok farklı değişikliğe yol açabilen bir dizi hücre içi etkileşime neden olur. Nörofarmakoloji alanındaki nörotransmiter / reseptör etkileşimleri son derece önemlidir, çünkü bugün geliştirilen birçok ilaç bu bağlanma sürecini bozmakla ilgilidir.[4]
Moleküler nörofarmakoloji
Moleküler nörofarmakoloji, ağrı, nörodejeneratif hastalıklar ve psikolojik bozukluklar (bu durumda nöropsikofarmakoloji olarak da bilinir) yeni ilaçlar geliştirmek amacıyla nöronların ve bunların nörokimyasal etkileşimlerinin ve nöronlar üzerindeki reseptörlerin incelenmesini içerir. Nörotransmisyon-reseptör eylemiyle ilişkilendirirken tanımlanması gereken birkaç teknik kelime vardır:
- Agonist - bir reseptör proteinine bağlanan ve bu reseptörü aktive eden bir molekül
- Rekabetçi antagonist - reseptör aktivasyonunu önleyen, agonist ile reseptör proteini üzerindeki aynı bölgeye bağlanan bir molekül
- Rekabetçi olmayan antagonist - agonistinkinden farklı bir bölgedeki bir reseptör proteinine bağlanan, ancak proteinde aktivasyona izin vermeyen konformasyonel bir değişikliğe neden olan bir moleküldür.
Aşağıdaki nörotransmitter / reseptör etkileşimleri, yukarıdaki üçten biri olarak işlev gören sentetik bileşiklerden etkilenebilir. Sodyum / potasyum iyon kanalları ayrıca aksiyon potansiyellerinin inhibe edici etkilerini indüklemek için bir nöron boyunca manipüle edilebilir.
GABA
GABA nörotransmitter merkezi sinir sistemindeki hızlı sinaptik inhibisyona aracılık eder. GABA pre-sinaptik hücresinden salındığında, post-sinaptik hücrenin hiperpolarize olmasına (eylem potansiyel eşiğinin altında kalmasına) neden olan bir reseptöre (büyük olasılıkla GABA A reseptörü) bağlanacaktır. Bu, diğer nörotransmitter / reseptör etkileşimlerinden herhangi bir uyarıcı manipülasyonun etkisine karşı koyacaktır.
Bu GABA A reseptörü, konformasyonel değişikliklere izin veren ve ilaç gelişimi için birincil hedef olan birçok bağlanma yeri içerir. Bu bağlanma bölgelerinin en yaygın olanı, benzodiazepin, reseptör üzerinde hem agonist hem de antagonist etkilere izin verir. Yaygın bir ilaç olan diazepam, bu bağlanma bölgesinde allosterik bir güçlendirici görevi görür.[5] GABA B olarak bilinen GABA için başka bir reseptör, baklofen adı verilen bir molekül tarafından güçlendirilebilir. Bu molekül bir agonist olarak hareket eder, bu nedenle reseptörü aktive eder ve spastik hareketi kontrol etmeye ve azaltmaya yardımcı olduğu bilinmektedir.
Dopamin
Dopamin nörotransmitter, beş spesifik GPCR'ye bağlanarak sinaptik iletime aracılık eder. Bu beş reseptör proteini, tepkinin sinaptik sonrası hücre üzerinde uyarıcı veya önleyici bir tepki ortaya çıkarması nedeniyle iki sınıfa ayrılır. Dopamin ve beyindeki etkileşimlerini etkileyen yasal ve yasadışı birçok ilaç türü vardır. Beyindeki dopamin miktarını azaltan bir hastalık olan Parkinson hastalığı ile, dopaminin kan-beyin bariyerini ve L-dopa kutusunu geçememesi nedeniyle hastaya dopamin öncüsü Levodopa verilir. Huzursuz bacak sendromu veya RLS olarak bilinen bir bozukluğu olan Parkinson hastalarına bazı dopamin agonistleri de verilir. Bunların bazı örnekleri ropinirol ve pramipeksoldür.[6]
Dikkat eksikliği hiperaktivite bozukluğu (DEHB) gibi psikolojik bozukluklar, dopaminin pre-sinaptik hücre tarafından yeniden alımını bloke eden metilfenidat (Ritalin olarak da bilinir) gibi ilaçlarla tedavi edilebilir, böylece dopamin içinde kalan dopamin artışı sağlanır. sinaptik boşluk. Sinaptik dopamindeki bu artış, sinaptik sonrası hücrenin reseptörlerine bağlanmayı artıracaktır. Aynı mekanizma aynı zamanda kokain gibi diğer yasadışı ve daha güçlü uyarıcı ilaçlar tarafından da kullanılır.
Serotonin
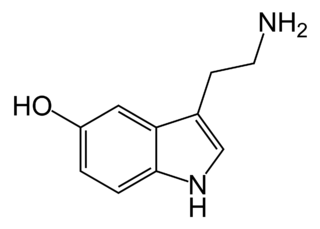
Nörotransmitter serotonin, GPCR veya LGIC reseptörleri yoluyla sinaptik iletim aracılık edebilir. Serotoninin uyarıcı veya önleyici sinaptik etkileri, belirli bir beyin bölgesinde eksprese edilen reseptör tipine göre belirlenir. Depresyon sırasında serotoninin düzenlenmesi için en popüler ve yaygın olarak kullanılan ilaçlar SSRI'lar veya seçici serotonin geri alım inhibitörleri olarak bilinir. Bu ilaçlar serotoninin pre-sinaptik nörona geri taşınmasını engeller ve sinaptik boşlukta daha fazla serotonin bırakır.
SSRI'ların keşfinden önce, serotonini parçalayan enzimi inhibe eden ilaçlar da vardı. MAOI'ler veya monoamin oksidaz inhibitörleri, sinapstaki serotonin miktarını arttırdı, ancak yoğun migren ve yüksek tansiyon dahil olmak üzere birçok yan etkisi vardı. Bu nihayetinde birçok gıda türünde bulunan tiramin olarak bilinen ortak bir kimyasalla etkileşime giren ilaçlarla bağlantılıydı.[7]
İyon kanalları
Nöronun yüzey zarında bulunan iyon kanalları, bir aksiyon potansiyeli sırasında sodyum iyonlarının akışına ve potasyum iyonlarının dışarı doğru hareketine izin verir. Bu iyon kanallarını seçici olarak bloke etmek, bir aksiyon potansiyelinin meydana gelme olasılığını azaltacaktır. İlaç riluzol, sodyum iyon kanallarını bloke eden nöroprotektif bir ilaçtır. Bu kanallar etkinleştirilemediğinden, herhangi bir eylem potansiyeli yoktur ve nöron, kimyasal sinyallerin elektrik sinyallerine dönüştürülmesini gerçekleştirmez ve sinyal ilerlemez. Bu ilaç anestezik olarak olduğu kadar sakinleştirici olarak da kullanılır.[8]
Davranışsal nörofarmakoloji

Davranışsal nörofarmakolojinin bir biçimi, uyuşturucu bağımlılığının araştırılmasına ve uyuşturucu bağımlılığının insan aklını nasıl etkilediğine odaklanır. Çoğu araştırma, beynin nörokimyasal ödülle bağımlılığı güçlendiren büyük kısmının çekirdek akudamları olduğunu göstermiştir . Sağdaki resim dopaminin bu alana nasıl yansıtıldığını göstermektedir. Kronik alkol kötüye kullanımı bağımlılığa ve bağımlılığa neden olabilir. Bu bağımlılığın nasıl meydana geldiği aşağıda açıklanmıştır.
Etanol
Alkolün ödüllendirici ve güçlendirici (yani bağımlılık yapan ) özelliklerine, ventral tegmental alanı nükleus akümülatlarına (NAcc) bağlayan mezolimbik ödül yolundaki dopamin nöronları üzerindeki etkileri aracılık eder.[9][10] Alkolün birincil etkilerinden biri, NMDA reseptörlerinin allosterik inhibisyonu ve GABA <sub id="mwfA">A</sub> reseptörlerinin kolaylaştırılmasıdır (örn. Reseptörün allosterik regülasyonu yoluyla gelişmiş GABA A reseptör aracılı klorür akısı).[11] Yüksek dozlarda, etanol nöronlardaki ligand geçitli iyon kanallarının ve voltaj geçitli iyon kanallarının çoğunu inhibe eder. Alkol, serebellumdaki sodyum-potasyum pompalarını inhibe eder ve muhtemelen serebellar hesaplamayı ve vücut koordinasyonunu bozar.[12][13]
Akut alkol tüketimi ile, mezolimbik yolun sinapslarında, postsinaptik D1 reseptörlerinin aktivasyonunun artmasıyla dopamin salınır.[9][10] Bu reseptörlerin aktivasyonu, sonuçta cAMP yanıt elemanı bağlayıcı proteini (CREB) fosforile eden protein kinaz A yoluyla postsinaptik dahili sinyal olaylarını tetikler ve gen ekspresyonunda CREB aracılı değişiklikleri indükler.
Kronik alkol alımı ile, etanol tüketimi benzer şekilde D1 reseptör yolu boyunca CREB fosforilasyonunu indükler, fakat aynı zamanda fosforilasyon mekanizmaları yoluyla NMDA reseptör fonksiyonunu değiştirir;[9][10] D1 reseptör yolunun ve CREB fonksiyonunun uyarlanabilir bir aşağı regülasyonu da meydana gelir. Kronik tüketim ayrıca bir MAPK / ERK yolu ve CAMK aracılı yol yoluyla postsinaptik NMDA reseptör sinyalleşme kaskadları üzerinden CREB fosforilasyonu ve fonksiyonu üzerindeki bir etki ile ilişkilidir. Mezolimbik yolakta CREB işlevinin bu modifikasyonlar ifadesini uyarmak (yani, artış, gen ekspresyonu) arasında ΔFosB NAcc içinde, ΔFosB NACC aşırı eksprese edildiğinde, bir "ana kontrol proteini" olduğu gerekli ve yeterli için bağımlılık yapıcı bir durumun geliştirilmesi ve sürdürülmesi (yani, nükleus akumbensindeki aşırı ekspresyonu kompulsif alkol tüketimini üretir ve daha sonra doğrudan modüle eder).[14][15][16]
Araştırma
Parkinson hastalığı
Parkinson hastalığı, substantia nigra'da bulunan dopaminerjik nöronların seçici kaybı ile tanımlanan nörodejeneratif bir hastalıktır . Bugün, bu hastalıkla savaşmak için en yaygın kullanılan ilaç levodopa veya L-DOPA'dır . Dopaminin bu öncüsü kan-beyin bariyerine nüfuz edebilirken, nörotransmitter dopamin giremez. L-dopa'nın Parkinson hastalığı için diğer dopamin agonistlerinden daha iyi bir tedavi olup olmadığını belirlemek için kapsamlı araştırmalar yapılmıştır. Bazıları, L-dopa'nın uzun süreli kullanımının nöroproteksiyonu tehlikeye atacağına ve sonuç olarak dopaminerjik hücre ölümüne yol açacağına inanmaktadır. Kanıt, in vivo veya in-vitro olmamasına rağmen, bazıları hala dopamin agonistlerinin uzun süreli kullanımının hasta için daha iyi olduğuna inanmaktadır.[17]
Alzheimer hastalığı
Alzheimer hastalığının nedeni için önerilen çeşitli hipotezler olsa da, bu hastalığın bilgisi tam olarak açıklanmaktan uzaktır ve tedavi yöntemleri geliştirmeyi zorlaştırmaktadır. Alzheimer hastalarının beyninde, hem nöronal nikotinik asetilkolin (nACh) reseptörlerinin hem de NMDA reseptörlerinin aşağı regüle edildiği bilinmektedir. Böylece, dört antikolinesteraz ABD Gıda ve İlaç Dairesi (FDA) tarafından ABD'deki tedavi için geliştirilmiş ve onaylanmıştır. Bununla birlikte, bunlar yan etkileri ve sınırlı etkileri göz önüne alındığında ideal ilaçlar değildir. Umut verici bir ilaç olan nefirasetam, Alzheimer ve demanslı diğer hastaların tedavisi için geliştirilmektedir ve hem nACh reseptörlerinin hem de NMDA reseptörlerinin aktivitesini güçlendirmek için benzersiz eylemlere sahiptir.[18]
Gelecek
Teknolojideki ilerlemeler ve sinir sistemi anlayışımızla ilaçların geliştirilmesi, artan ilaç duyarlılığı ve özgüllüğü ile devam edecektir. Yapı-aktivite ilişkileri nörofarmakolojide önemli bir araştırma alanıdır; biyoaktif kimyasal bileşiklerin etkisini veya kuvvetini (yani aktivitesini) kimyasal yapılarını değiştirerek değiştirme girişimi.[8]
Ayrıca bakınız
- Elektrofizyoloji
- Nöroendokrinoloji
- Nöropsikofarmakoloji
- Nörotransmisyon
- Nöroteknoloji
- Yapı-aktivite ilişkisi
Kaynakça
- ^ Yeung AWK, Tzvetkov NT, Atanasov AG. When Neuroscience Meets Pharmacology: A Neuropharmacology Literature Analysis 16 Aralık 2018 tarihinde Wayback Machine sitesinde arşivlendi.. Front Neurosci. 2018 Nov 16;12:852. doi: 10.3389/fnins.2018.00852 16 Aralık 2018 tarihinde Wayback Machine sitesinde arşivlendi..
- ^ Everitt (2005). "Neural systems of reinforcement for drug addiction: from actions to habits to compulsion". Nature Neuroscience. 8 (11). ss. 1481-1489.
- ^ a b Wrobel (2007). "Science, serotonin, and sadness: the biology of antidepressants: A series for the public". The FASEB Journal. 21 (13). ss. 3404-17.
- ^ Lovinger, D. M. (2008). "Communication Networks in the Brain Neurons, Receptors, Neurotransmitters, and Alcohol. [Review]". Alcohol Research & Health. 31 (3). ss. 196-214.
- ^ Sigel (2002). "Mapping of the benzodiazepine recognition site on GABA(A) receptors". Current Topics in Medicinal Chemistry. 2 (8). ss. 833-9.
- ^ Winkelman (2007). "Restless legs syndrome: nonpharmacologic and pharmacologic treatments". Geriatrics. 62 (10). ss. 13-6.
- ^ López-Muñoz (2009). "Monoaminergic neurotransmission: the history of the discovery of antidepressants from 1950s until today". Current Pharmaceutical Design. 15 (14). ss. 1563-1586.
- ^ a b Narahashi (2000). "Neuroreceptors and ion channels as the basis for drug action: past, present, and future". The Journal of Pharmacology and Experimental Therapeutics. 294 (1). ss. 1-26.
- ^ a b c "Alcoholism – Homo sapiens (human) Database entry". KEGG Pathway. 29 Ekim 2014. 11 Ağustos 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Şubat 2015.
As one of the primary mediators of the rewarding effects of alcohol, dopaminergic ventral tegmental area (VTA) projections to the nucleus accumbens (NAc) have been identified. Acute exposure to alcohol stimulates dopamine release into the NAc, which activates D1 receptors, stimulating PKA signaling and subsequent CREB-mediated gene expression, whereas chronic alcohol exposure leads to an adaptive downregulation of this pathway, in particular of CREB function. The decreased CREB function in the NAc may promote the intake of drugs of abuse to achieve an increase in reward and thus may be involved in the regulation of positive affective states of addiction. PKA signaling also affects NMDA receptor activity and may play an important role in neuroadaptation in response to chronic alcohol exposure.
- ^ a b c "Alcoholism – Homo sapiens (human)". KEGG Pathway. 29 Ekim 2014. 12 Kasım 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 31 Ekim 2014.
- ^ Eric Nestler; Steven Hyman; Robert Malenka (27 Ekim 2008). Molecular Neuropharmacology: A Foundation for Clinical Neuroscience, Second Edition (İngilizce). Mcgraw-hill. ISBN 9780071481274.
- ^ Forrest MD (Nisan 2015). "Simulation of alcohol action upon a detailed Purkinje neuron model and a simpler surrogate model that runs >400 times faster". BMC Neuroscience. 16 (27). s. 27.
- ^ "The neuroscience reason we fall over when drunk". Science 2.0. Nisan 2015. 5 Temmuz 2019 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Ocak 2019.
- ^ Ruffle JK (Kasım 2014). "Molecular neurobiology of addiction: what's all the (Δ)FosB about?". Am J Drug Alcohol Abuse. 40 (6). ss. 428-437.
ΔFosB as a therapeutic biomarker
The strong correlation between chronic drug exposure and ΔFosB provides novel opportunities for targeted therapies in addiction (118), and suggests methods to analyze their efficacy (119). Over the past two decades, research has progressed from identifying ΔFosB induction to investigating its subsequent action (38). It is likely that ΔFosB research will now progress into a new era – the use of ΔFosB as a biomarker. If ΔFosB detection is indicative of chronic drug exposure (and is at least partly responsible for dependence of the substance), then its monitoring for therapeutic efficacy in interventional studies is a suitable biomarker (Figure 2). Examples of therapeutic avenues are discussed herein. ...
Conclusions
ΔFosB is an essential transcription factor implicated in the molecular and behavioral pathways of addiction following repeated drug exposure. The formation of ΔFosB in multiple brain regions, and the molecular pathway leading to the formation of AP-1 complexes is well understood. The establishment of a functional purpose for ΔFosB has allowed further determination as to some of the key aspects of its molecular cascades, involving effectors such as GluR2 (87,88), Cdk5 (93) and NFkB (100). Moreover, many of these molecular changes identified are now directly linked to the structural, physiological and behavioral changes observed following chronic drug exposure (60,95,97,102). New frontiers of research investigating the molecular roles of ΔFosB have been opened by epigenetic studies, and recent advances have illustrated the role of ΔFosB acting on DNA and histones, truly as a ‘‘molecular switch’’ (34). As a consequence of our improved understanding of ΔFosB in addiction, it is possible to evaluate the addictive potential of current medications (119), as well as use it as a biomarker for assessing the efficacy of therapeutic interventions (121,122,124). Some of these proposed interventions have limitations (125) or are in their infancy (75). However, it is hoped that some of these preliminary findings may lead to innovative treatments, which are much needed in addiction. - ^ Nestler EJ (Aralık 2013). "Cellular basis of memory for addiction". Dialogues Clin Neurosci. 15 (4). ss. 431-443.
DESPITE THE IMPORTANCE OF NUMEROUS PSYCHOSOCIAL FACTORS, AT ITS CORE, DRUG ADDICTION INVOLVES A BIOLOGICAL PROCESS: the ability of repeated exposure to a drug of abuse to induce changes in a vulnerable brain that drive the compulsive seeking and taking of drugs, and loss of control over drug use, that define a state of addiction. ... A large body of literature has demonstrated that such ΔFosB induction in D1-type NAc neurons increases an animal's sensitivity to drug as well as natural rewards and promotes drug self-administration, presumably through a process of positive reinforcement
- ^ "Transcriptional and epigenetic mechanisms of addiction". Nat. Rev. Neurosci. 12 (11). Kasım 2011. ss. 623-637.
ΔFosB has been linked directly to several addiction-related behaviors ... Importantly, genetic or viral overexpression of ΔJunD, a dominant negative mutant of JunD which antagonizes ΔFosB- and other AP-1-mediated transcriptional activity, in the NAc or OFC blocks these key effects of drug exposure14,22–24. This indicates that ΔFosB is both necessary and sufficient for many of the changes wrought in the brain by chronic drug exposure. ΔFosB is also induced in D1-type NAc MSNs by chronic consumption of several natural rewards, including sucrose, high fat food, sex, wheel running, where it promotes that consumption14,26–30. This implicates ΔFosB in the regulation of natural rewards under normal conditions and perhaps during pathological addictive-like states. ... ΔFosB serves as one of the master control proteins governing this structural plasticity.
- ^ Shin (2009). "Neuroprotective effect of l-dopa on dopaminergic neurons is comparable to pramipexol in MPTP-treated animal model of Parkinson's disease: a direct comparison study". Journal of Neurochemistry. 111 (4). ss. 1042-50.
- ^ Narahashi (2003). "Unique mechanism of action of Alzheimer's drugs on brain nicotinic acetylcholine receptors and NMDA receptors". Life Sciences. 74 (2–3). ss. 281-91.