Molibden(V) klorür
 | |
 | |
| Adlandırmalar | |
|---|---|
Molibden(V) klorür Molibden pentaklorür | |
| Tanımlayıcılar | |
CAS numarası | |
| ECHA InfoCard | 100.030.510 |
| EC Numarası |
|
PubChem CID | |
| RTECS numarası |
|
| UNII | |
CompTox Bilgi Panosu (EPA) | |
| Özellikler | |
| Molekül formülü | Cl10Mo2 |
| Molekül kütlesi | 273.21 g/mol (MoCl5) |
| Görünüm | koyu yeşil katı nemçeker paramanyetik |
| Yoğunluk | 2.928 g/cm3 |
| Erime noktası | 194 °C (381 °F; 467 K) |
| Kaynama noktası | 268 °C (514 °F; 541 K) |
| Çözünürlük (su içinde) | hidrolize uğrar |
| Çözünürlük | kuru eter, kuru alkol, organik çözücüler 'de çözülür |
| Yapı | |
| monoklinik | |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
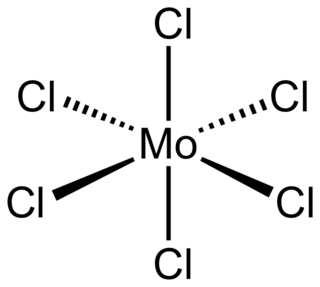
Molibden (V) klorür, [MoCl5]2 formülüne sahip olan bir bileşiktir. Bu koyu uçucu katı, diğer molibden bileşiklerini hazırlamak için araştırmada kullanılır. Neme duyarlıdır ve klorlu çözücülerde çözünür. Genelde molibden pentaklorür denir ve aslında Mo2Cl10 formüllü bir dimerdir.[1]
Yapısı
Her molibden atomu lokal oktahedral simetriye sahiptir.[2] W, Nb ve Ta'nın pentaklorürlerinde de benzer bir yapı bulunur. Gaz fazında ve kısmen çözelti halinde dimerler monomerik bir pentahalojenür vermek üzere kısmen ayrışır. Bu monomer paramanyetiktir. Bu monomerde Mo merkezlerinin her birinde bir eşlenmemiş elektron bulunmaktadır. Bunun sebebi ise Mo'nin değerliğinin +5 olmasıdır ve bundan dolayıdır ki metal merkezde bir elektron kalır.
Hazırlanması ve özellikleri
MoCl5 Mo metalinin klorlanmasıyla üretilmesine rağmen MoO3 ün klorlanmasıyla da üretilebilir. Bu yöntem kararsız olan molibden hekzaklorür (MoCl6 ) üretiminde kullanılmaz.[3]
MoCl5 güçlü bir yükseltgendir. MeCN tarafından turuncu bir kompleks ve diğer molibden komplekslerine öncü madde olan MoCl4(MeCN)2 üreterek yükseltgenir.[4] MoCl5 MoBr4 oluşturmak üzere HBr ile indirgenir. Brominasyon reaksiyonu etilbromürde MoBr5 'i ara ürün olarak oluşturarak −50 °C'de gerçekleştirilir. 20 °C ye ısıtıldığında Br2 ortaya çıkarak molibdenin değerliği +5'ten +4'e indirgenir. Bunun denklemi de şöyledir:
- 2 MoCl5 + 10 HBr → 2 MoBr4 + 10 HCl + Br2
MoBr4 THF(tetrahidrofuran) ile tepkimeye girerek Mo (III) içeren mer-MoBr3(THF)3'ü oluşturur.[5]
MoCl5, yükseltgenemeyen ligandlara karşı iyi bir Lewis asididir. Klor ile beraber [MoCl6]− iyonunu oluşturur. Organik sentezde, bileşiğin klorinasyon,deoksijenasyon ve yükseltgen eşleşme tepkimelerinde seyrek de olsa kullanım alanı bulur.[6]
Molibden hekzaklorür
Molibden (VI) klorür bilinse de MoCl5 'e klor eklenmesi ile hazırlanamaz.[7]
Güvenlik hususları
MoCl5 şiddetli bir yükseltgendir ve HCl açığa çıkarmak üzere kolayca hidrolize girer.
Kaynakça
- ^ Holleman, A. F.; Wiberg, E. (2001). Inorganic Chemistry. San Diego, CA: Academic Press. ISBN 0-12-352651-5.
- ^ Beck, J.; Wolf, F. (1997). "Three New Polymorphic Forms of Molybdenum Pentachloride". Acta Crystallogr. B53 (6). ss. 895-903. doi:10.1107/S0108768197008331.
- ^ Tamadon, Farhad; Seppelt, Konrad (2013). "The Elusive Halides VCl5, MoCl6, and ReCl6". Angew. Chem. Int. Ed. Cilt 52. ss. 767-769. doi:10.1002/anie.201207552. PMID 23172658.
- ^ Dilworth, J. R.; Richards, R. L. (1990). "The Synthesis of Molybdenum and Tungsten Dinitrogen Compounds". Inorg. Synth. Cilt 28. ss. 33-45. ISBN 0-471-52619-3.
- ^ Calderazzo, F.; Maichle-Mössmer, C.; Pampaloni, G.; Strähle, J. (1993). "Low-temperature Syntheses of Vanadium(III) and Molybdenum(IV) Bromides by Halide Exchange". Dalton Trans. 1993 (5). ss. 655-658. doi:10.1039/DT9930000655.
- ^ Kauffmann, T.; Torii, S.; Inokuchi, T. (2004). "Molybdenum(V) Chloride". Encyclopedia of Reagents for Organic Synthesis. New York, NY: J. Wiley & Sons. doi:10.1002/047084289X.rm280.
- ^ Tamadon, Farhad; Seppelt, K. (2012). "The Elusive Halides VCl5, MoCl6, and ReCl6". Angewandte Chemie International Edition. Cilt 52. ss. 767-769. doi:10.1002/anie.201207552.