Moleküller arası kuvvet
Moleküller arası kuvvet, komşu parçacıklar (atomlar, moleküller veya iyonlar) arasında etkili çekim veya itme kuvvetidir. Molekülleri bir arada tutan iç kuvvetlere kıyasla daha zayıftır. Örneğin HCI moleküllerinin içinde bulunan kovalent bağ, birbirine yeterince yakın komşu moleküller arasında mevcut olan kuvvetlerden daha güçlüdür.[1]
Çekici moleküller arası kuvvetler şunlardır:
- Hidrojen bağı
- İyon–dipol kuvvetleri
- Van der Waals kuvvetleri (Keesom kuvveti, Debye kuvveti ve London dağılım kuvveti)
(IMFs) komşu parçacıklar (atomlar, moleküller veya iyonlar) arasında hareket halindeki çekim ve itme kuvvetleridir. Bir molekülü bir arada tutan molekül içi kuvvetlerle karşılaştırıldığında, bu kuvvetler zayıftır. Örneğin, atomlar arası elektron çiflerinin elektron paylaşımını içeren kovalent bağ komşu moleküller arasında var olan kuvvetlerden daha güçlüdür. Bunlar moleküler mekanizmalarında sıklıkla kullanıan kuvvetl alanlarının önemli bir parçasıdır.
Moleküllerarası kuvvetler hakkındaki araştırmalar moleküler seviyede kuvvetlerin olması ve hareketine dikkat çeken iri ölçekli gözlemlerden başlar. Bu gözlemler virial faktörleri, buhar basıncını, vizkoziteyi, yüzeysel gerilim ve emilim verileri tarafından yansıtılan ideal olmayan gaz davranışını içerir. Mikroskopik kuvvetlere ilk referans Alexis Clairaut'un çalışması Theorie de la Figure de la Terre 'de değinilmiştir. Mikroskopik kuvvetlerin araştırmasına katkıda bulunan diğer bilim adamları: Laplace, Gauss, Maxwell ve Boltzmann'dır.
Aşağıdaki türler ile düşünülen çekici moleküllerarası kuvvetler:
- İyon uyarılmış dipol(iki kutuplu) etkileşimi
- İyon dipol etkileşimi
- van der Waals kuvvetleri (Keesom kuvveti, Debye j kuvveti ve London dağılım kuvveti)
Moleküllerarası kuvvetler hakkındaki bilgi vizkozite, PVT verisi gibi özelliklerin büyük ölçekli ölçümleri ile elde edilir. Mikroskopik etkenler için bağlantılar virial faktörlerle ve Lennard-Jones potansiyelleri tarafından verilir.
Dipol-dipol etkileşimleri
Dipol-dipol etkileşimleri moleküller içinde kalıcı dipoller arasındaki elektrostatik etkileşimlerdir. Bu etkileşimler çekimi artırmak için molekülleri sıralamaya meyillidirler (potansiyel enerji azalır). Dipol-dipol etkileşimine bir örnek hidrojen klorür (HCl) molekülünde görülebilir: polar bir molekülün pozitif sonu diğer molekülün negatif sonunu çekecektir ve pozisyonunu etkileyecektir. Polar moleküller arasında net bir çekim vardır. Polar moleküllere örnekler hidrojen klorür (HCl) ve kloroform (CHCl3) verilebilir.
- Dipol dipol polar yapılı moleküller üzerinde meydana gelen bir kimyasal reaksiyondur. Moleküllerin zıt kutupları arasında meydana gelen elektrostatik çekim kuvvetine dipol dipol denir. Bu bağlamda molekül içi bağlar polar kovalent bağ olarak ifade edilir. Bu bağlamda Molekülün polar karakteri sebebiyle arasında dipol dipol etkileşimi meydana gelmektedir. Yani molekülünün zıt kutup kısımları elektrostatik çekim ile beraber güçlü bir etkileşim meydana getirir. Bu etkileşim neticesinde çekim meydana gelir ve dipol dipol kuvveti oluşmaktadır.
- Kimyasal türlerde içinde barındırmış oldukları yapılar sebebi ile anlık değişimlerin olmadığı ve sürekliliğin olduğu moleküller kalıcı dipol olarak adlandırılmaktadır. Polar olan moleküllerde görülen dipoller kalıcı dipol olarak isimlendirilmektedir. Polar moleküllerde yükler simetrik bir şekilde dağılım göstermez. Bu nedenle de bileşke kuvvet sıfır değildir. Moleküllerde negatif ya da pozitif olmak üzere yük yoğunlukları bulunmaktadır. Moleküller içinde meydana gelen kutuplaşmalar süreklilik göstermeleri nedeni ile polar moleküllerde kalıcı dipoller oluşmaktadır. NH, HF, NH3, C2H5OH, H2O kalıcı dipole örnek olarak gösterilebilmektedir.
- Bazen moleküller iki kutuplu gruplar içerebilir, fakat toplam dipol momente sahip değildir. Bu durum molekül içinde bir simetri olduğunda, dipollerin birbirini yok etmesine neden olur. Tetrakloromethan ve karbondioksit gibi moleküller için bu geçerlidir. Iki ayrı atom arasında dipol-dipol etkileşiminin sıfır olduğunu not edin, çünkü atomlar nadiren kalıcı bir dipole sahip olurlar. İyon-dipol ve iyon-uyarılmış dipol kuvvetleri İyon-dipol ve iyon-uyarılmış dipol kuvvetleri dipol-dipol ve uyarılmış dipol etkileşimleri aynıdır, fakat sadece polar ve nonpolar moleküller yerine iyonları içerir. İyon-dipol ve iyon-uyarılmış dipol kuvvetleri dipol-dipol etkileşimlerinden daha güçlüdür, çünkü herhangi bir iyonun yükü bir dipol momentin yükünden daha büyüktür. Iyon-dipol bağları H bağından daha güçlüdür.[kaynak belirt] Bir iyon-dipol kuvveti bir iyon ve bir polar molekülün etkileşimini içerir. Maksimum etkileşime izin vermek için, pozitif ve negatif gruplar yan yana gelir. Bir iyon-uyarılmış dipol kuvveti bir iyon ve nonpolar(polar olmayan bir molekül) bir molekülün etkileşimini içerir. Dipol-uyarılmış dipol kuvveti gibi, iyon yükü nonpolar molekül üzerindeki elektron bulutunun bozulmasına neden olur. Hidrojen bağı[edit] Ana makale: Hidrojen bağı H bağı elektronegatif bir atomun eşleşmemiş elektronları ve azot, oksijen ve florin atomuna bağlı bir H atomu arasındaki çekimdir. H bağı genellikle güçlü bir elektrostatik dipol-dipol etkileşimidir. Ancak, kovalent bağın bazı özelliklerini taşır: yönlüdür, van der Waals etkileşimlerinden güçlüdür, van der Waals çapının toplamından daha kısa bir atom içi uzaklık yaratır ve genellikle değerlik türü gibi yorumlanabilen sınırlı sayıdaki etkileşen grupları içerir.
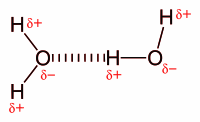 Moleküllerarası H bağı, H bağına sahip olmayan diğer Grup 16 hidritleriyle karşılaştırıldıklarında, suyun neden yüksek bir sıcaklıkta (100 °C) kaynadığını gösterir. Molekül içi oksijen hidrojen bağı, proteinlerin ve nükleik asitlerin ikincil, üçüncül, dördüncül yapılarından kısmen sorumludur. Ayrıca sentetik ve doğal polymerlerin yapısında da önemli bir rol oynar. Van der Waals kuvvetleri Ana makale: van der Waals kuvveti Van der Waals kuvvetleri, yüksüz atom veya moleküller arasındaki etkileşimden doğar. Sıkışmış fazların kohezyonu ve gazların fiziksel adsorpsiyonu gibi olaylara neden olur, fakat büyük ölçekli hacimler arası evrensel bir çekim gücü yaratır. Keesom (kalıcı-kalıcı dipoller) etkileşimi Van der Waals kuvvetlerine ilk katkı, yükler arasındaki (moleküler iyonlarda) elektrostatik etkileşimler, dipoller (polar moleküller için), dörtlüler (simetrik tüm moleküller) ve kalıcı çok kutuplulardan gelir. Bu etkileşim Keesom etkileşimidir (Willem Hendrik Keesom'dan sonra isimlendirilmiştir.). Bu kuvvetler kalıcı dipoller (dipolar moleküller) arasındaki çekimlerdir ve sıcaklığa bağlıdırlar. Bunlar dipoller arası çekici etkileşimlerden oluşur ve dipollerin farklı dönme hareketlerinin ortalama olarak toplamıdır. Moleküllerin sürekli döndüğü ve bir yerde sabit kalmadığı varsayılır. Keesom etkileşimi enerjisi; uzaklığın üçüncü kuvvetinin tersine bağlı olan uzaysal sabit iki dipolün etkileşim enerjisinden farklı olarak, uzaklığın altıncı kuvvetinin tersine bağlıdır. Keesom etkileşimi sadece moleküller arasında olur, aynı zamanda iki polar molekül olarak da bilinen kalıcı dipol momentlere sahiptir. Keesom etkileşimleri çok zayıf van der Waals etkileşimleridir ve elektrolit içeren sulu çözeltilerde görülmez. Aşağıdaki denklemde ortalama açı etkileşimi verilmiştir:
Moleküllerarası H bağı, H bağına sahip olmayan diğer Grup 16 hidritleriyle karşılaştırıldıklarında, suyun neden yüksek bir sıcaklıkta (100 °C) kaynadığını gösterir. Molekül içi oksijen hidrojen bağı, proteinlerin ve nükleik asitlerin ikincil, üçüncül, dördüncül yapılarından kısmen sorumludur. Ayrıca sentetik ve doğal polymerlerin yapısında da önemli bir rol oynar. Van der Waals kuvvetleri Ana makale: van der Waals kuvveti Van der Waals kuvvetleri, yüksüz atom veya moleküller arasındaki etkileşimden doğar. Sıkışmış fazların kohezyonu ve gazların fiziksel adsorpsiyonu gibi olaylara neden olur, fakat büyük ölçekli hacimler arası evrensel bir çekim gücü yaratır. Keesom (kalıcı-kalıcı dipoller) etkileşimi Van der Waals kuvvetlerine ilk katkı, yükler arasındaki (moleküler iyonlarda) elektrostatik etkileşimler, dipoller (polar moleküller için), dörtlüler (simetrik tüm moleküller) ve kalıcı çok kutuplulardan gelir. Bu etkileşim Keesom etkileşimidir (Willem Hendrik Keesom'dan sonra isimlendirilmiştir.). Bu kuvvetler kalıcı dipoller (dipolar moleküller) arasındaki çekimlerdir ve sıcaklığa bağlıdırlar. Bunlar dipoller arası çekici etkileşimlerden oluşur ve dipollerin farklı dönme hareketlerinin ortalama olarak toplamıdır. Moleküllerin sürekli döndüğü ve bir yerde sabit kalmadığı varsayılır. Keesom etkileşimi enerjisi; uzaklığın üçüncü kuvvetinin tersine bağlı olan uzaysal sabit iki dipolün etkileşim enerjisinden farklı olarak, uzaklığın altıncı kuvvetinin tersine bağlıdır. Keesom etkileşimi sadece moleküller arasında olur, aynı zamanda iki polar molekül olarak da bilinen kalıcı dipol momentlere sahiptir. Keesom etkileşimleri çok zayıf van der Waals etkileşimleridir ve elektrolit içeren sulu çözeltilerde görülmez. Aşağıdaki denklemde ortalama açı etkileşimi verilmiştir: - m = her uzunluk için yük, = boş uzayın elektriksel geçirgenliği, = ortamdaki diğer malzemenin dielektrik sabiti, T = sıcaklık, = Boltzmann sabiti ve r = moleküller arası uzaklık Debye (kalıcı-uyarılmış dipoller) kuvveti Ikinci katkı indüksiyon (polarizasyon-kutuplaşma olarak da bilinir) veya Debye kuvvetidir. Dönen kalıcı dipoller arasındaki etkileşimlerden ve atomlar ya da moleküllerin (kutuplaşmış dipoller) kutuplaşabilirliğinden oluşur. Bu kutuplaşmış dipoller kalıcı dipole sahip diğer moleküllerin elektronlarını itmelerinden oluşur. Kalıcı dipole sahip bir molekül benzer komşu moleküllerde çift kutup oluşturur ve ortak bir çekime neden olur. Debye kuvvetleri atomlar arasında oluşmaz. Kutuplaşmış ve kalıcı dipoller arasındaki kuvvetler Keesom etkileşimleri gibi sıcaklığa bağlı değildir, çünkü kutuplaşmış dipol yer değiştirebilir ve nonpolar bir molekülün çevresinde döner. Debye kutuplaşma etkileri ve Keesom yönelim etkileri polar etkileşimler olarak sayılır. Kutuplaşmış dipol kuvvetleri bir moleküldeki kalıcı çoklu kutup ile diğer moleküldeki kutuplaşmış çoklu kutup arasındaki çekim etkisinden oluşan kutuplanmadan (polarizasyon olarak da bilinir) ortaya çıkar. Bu etkileşim Debye kuvveti olarak adlandırılır, Peter J.W. Debye'den sonmra isimlendirilmiştir. Kalıcı dipol ve uyarılmış dipol arasındaki endüksiyon-etkileşimin bir örneği HCl ve Ar arasındaki etkileşimdir. Bu sistemde, Ar'nun elektronları çekilir (HCl'nin H tarafına) ya da HCl tarafından(Cl tarafından) itilir ve bir dipol oluşur. Ortalama açı etkileşimi aşağıdaki denklemde verilmiştir:
= polarizasyon (kutuplaşma) Bu tür bir etkileşim herhangi bir polar molekül ve nonpolar/simetrik molekül arasında gerçekleşebilir. Endüksiyon-etkileşim kuvveti dipol-dipol etkileşiminden çok zayıftır, ancak London dağılım kuvvetinden güçlüdür. London dağılım kuvveti (dipol-uyarılmış dipol etkileşimi) Ana makale: London dağılım kuvveti Üçüncü ve en baskın katkı dağılım ya da London kuvvetidir (dipol-uyarılmış dipol dalgalanması), tüm atom ya da moleküllerin sıfır olmayan anlık dipole momentlerinden oluşur. Bu gibi bir kutuplaşma polar bir molekül ya da nonpolar moleküllerde negatif yüklü elektron bulutlarının itmes sonucu uyarılmalarıyla oluşur. Bu yüzden, London etkileşimleri bir elekton bulutundaki elektron yoğunluğunun rastgele dalgalanmasından meydana gelir. Fazla elektrona sahip bir atom daha az elektrona sahip bir atomdan yüksek London kuvvetine sahiptir. Dağılım (London) kuvveti kutuplaşabilen tüm malzemeler için en önemli bileşendir, Keesom ve Debye kuvvetleri kalıcı dipoller gerektirir. London etkileşimi evrenseldir ve atom-atom etkileşimlerinde vardır. Çeşitli nedenlerden dolayı London etkileşimlerinin (dağılımları) sıkıştırılmış sistemlerde büyük ölçekli hacimler arasındaki etkileşimlerle alakalı olduğu düşünülür. Hamaker 1937 yılında büyük ölçekli hacimler arasındaki van der Waals teorisini geliştirmiştir ve bu etkileşimlerin katkısının daha uzun aralıkta açıklanabileceğini göstermiştir. Kuvvetlerin göreceli gücü |Bağ türü |Ayrışma enerjisi (kcal/mol)[9] |- |İyon kafesi enerjisi |250–4000 [10] |- |Kovalent bağ enerjisi |30–260 |- |Hidrojen bağı |1–12 (suda yaklaşık 5'tir) |- |Dipol–Dipol |0.5–2 |- |London Dağılımı Kuvvetleri |<1 to 15 (hidrokarbonların buharlaşma entalpilerinden tahmin edilir) |} Not: Bu karşılaştırma ortalamadır – gerçek göreceli güçler içerdiği moleküllere bağlı olarak değişiklik gösterir. İyonik ve kovalent bağ her zaman herhangi verilen bir madde için moleküllerarası kuvvetlerden daha güçlüdür. Gazların davranışının etkisi Moleküllerarası kuvvetler kısa mesafelerde iticidir ve uzun mesafelerde çekicidir (Lennard-Jones potansiyeline bakınız). Bir gazda, itici kuvvet temel olarak aynı hacmi kaplayan iki molekülün tutulması etkisine sahiptir. Aynı sıcaklık ve basıçta gerçek gaz ideal bir gazdan daha fazla hacim kaplamaya meyillidir. Çekici kuvvetler molekülleri bir arada tutar ve daha küçük hacim kaplaması için basınç ve sıcaklığa bağlı olan ideal bir gazdan gerçek gaza doğru bir eğilim gösterir (sıkıştırılabilirlik etkenine bakınız). Bir gazda, moleküllerarası uzaklık genellikle büyüktür; bu yüzden moleküllerarası kuvvetler sadece küçük bir etki gösterir. İtici kuvvet çekici kuvvetin üstesinden gelemez, fakat moleküllerin termal enerjisi çekici kuvvetin üstesinden gelir. Sıcaklık termal enerjinin bir ölçüsüdür, böylece artan sıcaklık çekici kuvvetin etkisini azaltır. Buna zıt olarak, itici kuvvetin etkisi özellikle sıcaklıktan etkilenmez. Özkütlesini artırmak için bir gaz sıkıştırıldığında, çekici kuvvetin etkisi artar. Eğer bir gaz yeterince yoğun ise, moleküller yayılsın diye etkileşimler termal hareketin üstesinden gelmesi için artmaya başlayabilir. Ardından gaz bir katı ya da sıvı oluşturmak için yoğunlaşabilir. Düşük sıcaklıklar yoğunlaşma fazının oluşumunu destekler. Yoğun bir fazda, çekici ve itici kuvvetler arasında bir denge vardır. Kuantum mekanik teorileri [edit] Ana makale: Moleküllerarası etkileşimlerinin kuantum mekaniği ile açıklanması {| class="wikitable" | |Bu kısım genişlemeyi içerir. (Eylül 2009) |} Atomlar ve moleküller arasındaki moleküllerarası kuvvetler, yukarıda açıklandığı gibi kalıcı ve anlık dipoller arasında oluşur. Bunun yerine, H bağı, van der Waals ve dipol-dipol gibi çeşitli etkileşimleri açıklamak için daha temel ve birleştirici bir teori aranabilir. Sıklıkla, moleküllere kuantum mekaniği fikirlerinin uygulanmasıyla bu teori gerçekleştirilebilir ve Rayleigh–Schrödinger düzensizlik teorisi bu noktada etkili olabilir. Moleküllerarası etkileşimlerin kuantum mekanik açıklaması gibi var olan kuantum kimya teknikleri uygulandığında, bu etkileşimleri analiz etmekte kullanılabilen ortalama tekniklerinin bir dizilimini sağlanabilir.
Kaynakça
- ^ "Türkçe Bilgi: Moleküller arası kuvvet". Türkçe Bilgi. Erişim tarihi: 26 Şubat 2021.



















