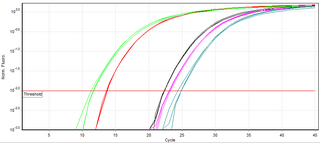
Moleküler tanı

Moleküler tanı, moleküler yöntemlerle hastalıklara tanı koymayı amaçlayan bir disiplindir.[1] Moleküler tanı, genomdaki ve proteomdaki biyolojik belirteçleri ve hücrelerinin genlerini protein olarak nasıl ifade ettiğini, moleküler biyolojiyi tıbbi testlere uygulayarak analiz etmek için kullanılan tekniklerin bir koleksiyonudur. Tıpta hastalığı teşhis etmek ve izlemek, riski tespit etmek ve bireysel hastalar için en iyi hangi tedavilerin işe yarayacağına karar vermek ve tarımsal biyogüvenlikte benzer şekilde mahsul ve hayvan hastalıklarını izlemek, riski tahmin etmek ve hangi karantina önlemlerine karar vermek için kullanılmaktadır.[2][3][4]
Moleküler teşhis, hastanın özelliklerini ve hastalığını analiz ederek kişiselleştirilmiş tıp olasılığını sunmaktadır.[5] Bu testler; bulaşıcı hastalık, onkoloji, insan lökosit antijen tiplemesi (bağışıklık fonksiyonunu araştıran ve öngören), pıhtılaşma ve farmakogenomik (hangi ilaçların en iyi sonucu vereceğine dair genetik tahmin) dahil olmak üzere bir dizi tıbbi uzmanlık alanında faydalıdır.[6]
Teknikler
Araştırma araçlarından geliştirme
Moleküler biyoloji tahlil araçlarının endüstrileşmesi, bunların kliniklerde kullanılmasını pratik hale getirmiştir.[3] Tek bir el cihazına minyatürleştirme tıbbi teşhisleri kliniğe, ofise veya eve getirebilmektedir.[3] Klinik laboratuvar, yüksek güvenilirlik standartları gerektirmektedir. Teşhis, akreditasyon gerektirebilir veya tıbbi cihaz düzenlemeleri kapsamına girebilmektedir.[7] 2011 itibarıyla bazı ABD klinik laboratuvarları yine de "Yalnızca araştırma amaçlı" satılan tahlilleri kullanmıştır.[8]
Tahliller
Moleküler teşhis, PCR-ELISA veya Floresan in situ hibridizasyon gibi yapay ortamda biyolojik tahlilleri kullanmaktadır.[9] Test, bir hastadan alınan numuneden, genellikle düşük konsantrasyonlarda hastalık veya risk belirteci olan bir molekülü tespit etmektedir. Analizden önce numunenin korunması çok önemlidir. Elle taşıma en aza indirilmelidir.[10] Numuneler sıvı nitrojen içine anında dondurulabilmektedir veya koruyucu maddeler içinde inkübe edilebilmektedir.[3]
Moleküler tanı yöntemleri hassas belirteçleri tespit edebildiğinden, bu testler geleneksel biyopsiden daha az müdahalecidir. Örneğin, insan plazmasında hücresiz nükleik asitler bulunduğundan, tümörlerden, transplantlardan veya doğmamış bir fetüsten genetik bilgi örneklemek için basit bir kan örneği yeterli olabilmektedir.[3] Nükleik asitlerin saptanmasına dayanan moleküler tanı yöntemlerinin (çoğu ancak hepsi değil) nükleik asit moleküllerinin sayısını büyük ölçüde artırmak için polimeraz zincir reaksiyonunu (PCR) kullanmaktadır. Bu sayede hasta numunesindeki hedef dizileri çoğalmaktadır.[3] PCR şu anda DNA dizilerinin tespiti için en yaygın kullanılan yöntemdir.[11]
Moleküler tanı testleri hassasiyet, geri dönüş süresi, maliyet, kapsam ve düzenleyici onay açısından büyük farklılıklar göstermektedir. Ayrıca, bunları kullanan laboratuvarlarda uygulanan doğrulama düzeyine göre de farklılık göstermektedirler. Bu nedenle, özellikle sonucun bir hasta tedavi kararını bildirmek için kullanılabileceği durumlarda, düzenleyici gerekliliklere uygun olarak sağlam yerel doğrulama ve uygun kontrollerin kullanılması gereklidir.[12]
Doğum öncesi
Down Sendromu gibi kromozomal anormallikler için geleneksel doğum öncesi testler, kromozomların (karyotip) sayısını ve görünümünü analiz etmeye dayanmaktadır. Mikrodizi karşılaştırmalı genomik hibridizasyon gibi moleküler tanı testleri, bunun yerine bir DNA örneğini test eder ve plazmadaki hücre içermeyen DNA nedeniyle daha az invaziv olabilmektedir ancak 2013 itibarıyla hala geleneksel testlere ektir.[13]
Tedavi

Bir hastanın tek nükleotid polimorfizmlerinden bazıları—DNA'larındaki küçük farklılıklar—belirli ilaçları ne kadar hızlı metabolize edeceklerini tahmin etmeye yardımcı olabilmektedir; buna farmakogenomik denmektedir.[14] Örneğin, CYP2C19 enzimi, pıhtılaşma önleyici ajan Clopidogrel gibi çeşitli ilaçları aktif formlarına metabolize etmektedir. Bazı hastalarda 2C19 geninin belirli yerlerinde bu ilaçları zayıf metabolize eden polimorfizmler bulunmaktadır. Doktorlar bu polimorfizmleri test edebilmekte ve ilaçların o hasta için tam olarak etkili olup olmayacağını öğrenebilmektedirler.[15] Moleküler biyolojideki gelişmeler, daha önce tek bir hastalık olarak sınıflandırılan bazı sendromların aslında tamamen farklı nedenleri ve tedavileri olan çoklu alt tipler olduğunu göstermeye yardımcı olmuştur. Moleküler teşhis, alt tipin (örneğin enfeksiyonlar ve kanserler) veya Silver-Russell sendromu gibi kalıtsal bir bileşeni olan bir hastalığın genetik analizinin teşhisine yardımcı olabilmektedir.[2][16]
Bulaşıcı hastalık
Moleküler teşhisler, klamidya,[17] influenza virüsü[18] ve tüberküloz[19] gibi bulaşıcı hastalıkları veya H1N1 virüsü[20] veya SARS-CoV-2 gibi spesifik suşları[21] tanımlamak için kullanılmaktadır. Genetik tanımlama hızlı olabilmektedir. Örneğin döngü aracılı izotermal amplifikasyon testi, sıtma parazitini teşhis etmektedir ve gelişmekte olan ülkeler için yeterince sağlamdır.[22] Moleküler teşhis ayrıca patojenin spesifik suşunu anlamak için de kullanılmaktadır. Örneğin hangi ilaca direnç genlerine sahip olduğunu tespit etmektedir. Dolayısıyla hangi tedavilerden kaçınılması gerektiğini de belirlemektedir.[23]
Hastalık risk yönetimi
Bir hastanın genomu, gelecekte bir hastalık geliştirme olasılığını etkileyen kalıtsal veya rastgele bir mutasyon içerebilmektedir.[24] Örneğin Lynch sendromu, hastaları kolorektal ve diğer kanserlere yatkın hale getiren genetik bir hastalıktır. Erken teşhis, hastanın iyi bir sonuç alma şansını artıran yakın izlemeye yol açabilmektedir.[25] Kardiyovasküler risk biyolojik belirteçlerle belirtilmektedir ve tarama, bir çocuğun Kistik fibroz gibi genetik bir hastalıkla doğma riskini ölçebilmektedir.[26] Genetik testler etik olarak karmaşıktır. Hastalar risklerini bilme stresini istemeyebilirler.[27]
Moleküler tanının kullanım alanları
- Mikrobiyoloji: Hastalıklardan sorumlu parazitlerin, bakteri ve virüslerin tanımlanmasında kullanılmaktadır.
- İmmünoloji
- Genetik
Moleküler Test Sonuçlarını Etkileyen Faktörler Nelerdir?
Moleküler testler, insan sağlığı için önemli hastalıkların teşhisinde kullanılmaktadır.[28] Bu nedenle test sonuçlarında herhangi bir yanıltıcılığa sebep olacak faktörler, mümkün olduğunca önlenmeye çalışılmalıdır.[28] Faktörlerin biri ya da birden fazlasının teste etki etmesi, sonuçlardaki hata payında farklılıklar ortaya koyabilmektedir.[28]
Hasta Bilgileri
Hastaya test öncesi yapılacak önemli işlemlerden biri, hasta kaydını almaktır.[28] Hastanın yaşı, cinsiyeti, herhangi bir hastalığı olup olmadığı, fizyolojik ve psikolojik durumu gibi etmenler; test sonucunda beklenmedik değerler meydana getirebilmektedir.[28] Hastanın herhangi bir ilaç kullanıp kullanmadığı da oldukça önemlidir.[28]
Numune Seçimi
Teste tabii tutulacak örnek, test sonucunu olumsuz etkileyebilecek faktörler arasında yer almaktadır.[28] Hastalık tutulumu meydana gelen doku göz önüne alınarak numunenin dikkatlice seçilmesi gerekmektedir.[28] Yanlış numunenin tercih edilmesi, hastalığın tespit edilme süresini uzatabilmektedir; bu da kişinin sağlık durumunda kritik durumlara yol açabilmektedir.[28] Ayrıca dokuya göre farklı test uygulanacağı için yanlış numune, farklı testlerde ve farklı değerler ortaya koyabilmektedir.[28]
Numunenin Muhafaza Edilmesi
Numunenin yapısının bozulmayacağı bir sıcaklıkta bekletilmesi, uygun bir kaba konulması ve test süresine kadar numunenin saflığının korunması; testin hata payını en aza indirger.[28]
Uygun Prob Kullanılması
Moleküler testlerin ana mekanizması, problar ve probların DNA ile ilişkisidir.[28] Problar, DNA'nın seçilen bölgesini tanıma ve işaretleme amacıyla kullanılan birimdir.[28] Bu neden taranacak hastalığa göre DNA'nın hangi bölümünün inceleneceği bilinmeli, o bölgeye uygun prob seçimiyle gen dizisine ulaşılmalıdır.[28] Kullanılacak yanlış prob, hastalık bulgusu olmayan DNA bölgesinde araştırma yapılmasına neden olur ve hastalığa tanı koyma süresi uzar.[28]
Ayrıca bakınız
- Moleküler tıp
- Moleküler patoloji
- Patogenez
- Patojenomik
- Patoloji
- Hassas tıp
- Kişiselleştirilmiş tıp
Kaynakça
- ^ "Moleküler Tanı" (PDF). 27 Kasım 2020 tarihinde kaynağından (PDF) arşivlendi.
- ^ a b Poste, George (1 Mayıs 2001). "Molecular diagnostics: a powerful new component of the healthcare value chain". Expert Review of Molecular Diagnostics. 1 (1): 1-5. doi:10.1586/14737159.1.1.1. ISSN 1473-7159.
- ^ a b c d e f Burtis, Carl A.; Ashwood, Edward R.; Bruns, David E. (14 Ekim 2012). Tietz Textbook of Clinical Chemistry and Molecular Diagnostics - E-Book (İngilizce). Elsevier Health Sciences. ISBN 978-1-4557-5942-2. 24 Haziran 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Haziran 2021.
- ^ "ITP | About ITP". idtools.org. 6 Haziran 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Haziran 2021.
- ^ Hamburg, Margaret A.; Collins, Francis S. (22 Temmuz 2010). "The Path to Personalized Medicine". New England Journal of Medicine. 363 (4): 301-304. doi:10.1056/NEJMp1006304. ISSN 0028-4793. PMID 20551152.
- ^ Grody, Wayne W.; Nakamura, Robert M.; Kiechle, Frederick L.; Strom, Charles (6 Kasım 2009). Molecular Diagnostics: Techniques and Applications for the Clinical Laboratory (İngilizce). Academic Press. ISBN 978-0-08-091904-1. 24 Haziran 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Haziran 2021.
- ^ Gibbs, Jeffrey N. N. (1 Ağustos 2008). "Regulatory Pathways for Molecular Dx". GEN - Genetic Engineering and Biotechnology News (İngilizce). 22 Eylül 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Haziran 2021.
- ^ Gibbs, Jeffrey N. N. (1 Nisan 2011). "Uncertainty Persists with RUO Products". GEN - Genetic Engineering and Biotechnology News (İngilizce). 24 Haziran 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Haziran 2021.
- ^ Molecular diagnostics : current technology and applications. J. R. Rao, Colin C. Fleming, John E. Moore. Wymondham, Norfolk, U.K.: Horizon Bioscience. 2006. ISBN 978-1-904933-19-9. OCLC 68263371.
- ^ Hammerling, Julie A. (2012). "A Review of Medical Errors in Laboratory Diagnostics and Where We Are Today: Table 1". Laboratory Medicine (İngilizce). 43 (2): 41-44. doi:10.1309/LM6ER9WJR1IHQAUY. ISSN 0007-5027. 21 Aralık 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Haziran 2021.
- ^ "Diagnostics based on nucleic acid sequence variant profiling: PCR, hybridization, and NGS approaches". Advanced Drug Delivery Reviews (İngilizce). 105: 3-19. 1 Ekim 2016. doi:10.1016/j.addr.2016.04.005. ISSN 0169-409X. 24 Haziran 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Haziran 2021.
- ^ Sherwood, James L; Brown, Helen; Rettino, Alessandro; Schreieck, Amelie; Clark, Graeme; Claes, Bart; Agrawal, Bhuwnesh; Chaston, Ria; Kong, Benjamin S G; Choppa, Paul; Nygren, Anders O H (28 Eylül 2017). "Key differences between 13 KRAS mutation detection technologies and their relevance for clinical practice". ESMO Open. 2 (4). doi:10.1136/esmoopen-2017-000235. ISSN 2059-7029. PMC 5623342 $2. PMID 29018576.
- ^ Shaffer, Lisa G; Rosenfeld, Jill A (2013). "Microarray-based prenatal diagnosis for the identification of fetal chromosome abnormalities". Expert Review of Molecular Diagnostics. 13 (6): 601-611. doi:10.1586/14737159.2013.811912. ISSN 1473-7159.
- ^ "Nationa cancer institute". 26 Eylül 2006 tarihinde kaynağından arşivlendi.
- ^ Desta, Zeruesenay; Zhao, Xiaojiong; Shin, Jae-Gook; Flockhart, David A. (1 Ekim 2002). "Clinical Significance of the Cytochrome P450 2C19 Genetic Polymorphism". Clinical Pharmacokinetics (İngilizce). 41 (12): 913-958. doi:10.2165/00003088-200241120-00002. ISSN 1179-1926.
- ^ Eggermann, Thomas; Spengler, Sabrina; Gogiel, Magdalena; Begemann, Matthias; Elbracht, Miriam (1 Haziran 2012). "Epigenetic and genetic diagnosis of Silver–Russell syndrome". Expert Review of Molecular Diagnostics. 12 (5): 459-471. doi:10.1586/erm.12.43. ISSN 1473-7159. PMID 22702363.
- ^ Tong, CY William; Mallinson, Harry (1 Mayıs 2002). "Moving to nucleic acid-based detection of genital Chlamydia trachomatis". Expert Review of Molecular Diagnostics. 2 (3): 257-266. doi:10.1586/14737159.2.3.257. ISSN 1473-7159.
- ^ Deyde, Varough M.; Sampath, Rangarajan; Gubareva, Larisa V. (1 Ocak 2011). "RT-PCR/electrospray ionization mass spectrometry approach in detection and characterization of influenza viruses". Expert Review of Molecular Diagnostics. 11 (1): 41-52. doi:10.1586/erm.10.107. ISSN 1473-7159.
- ^ Pai, Madhukar; Kalantri, Shriprakash; Dheda, Keertan (1 Mayıs 2006). "New tools and emerging technologies for the diagnosis of tuberculosis: Part I. Latent tuberculosis". Expert Review of Molecular Diagnostics. 6 (3): 413-422. doi:10.1586/14737159.6.3.413. ISSN 1473-7159.
- ^ Burkardt, Hans-Joachim (1 Ocak 2011). "Pandemic H1N1 2009 ('swine flu'): diagnostic and other challenges". Expert Review of Molecular Diagnostics. 11 (1): 35-40. doi:10.1586/erm.10.102. ISSN 1473-7159.
- ^ Habibzadeh, Parham; Mofatteh, Mohammad; Silawi, Mohammad; Ghavami, Saeid; Faghihi, Mohammad Ali (17 Şubat 2021). "Molecular diagnostic assays for COVID-19: an overview". Critical Reviews in Clinical Laboratory Sciences. 0 (0): 1-20. doi:10.1080/10408363.2021.1884640. ISSN 1040-8363. PMC 7898297 $2. PMID 33595397.
- ^ Han, Eun-Taek (1 Mart 2013). "Loop-mediated isothermal amplification test for the molecular diagnosis of malaria". Expert Review of Molecular Diagnostics. 13 (2): 205-218. doi:10.1586/erm.12.144. ISSN 1473-7159. PMID 23477559.
- ^ "Molecular diagnostics of infectious diseases". 8 Nisan 2020 tarihinde kaynağından arşivlendi.
- ^ "Cancer". 26 Eylül 2006 tarihinde kaynağından arşivlendi.
- ^ Lier, Margot G. F. Van; Wagner, Anja; Leerdam, Monique E. Van; Biermann, Katharina; Kuipers, Ernst J.; Steyerberg, Ewout W.; Dubbink, Hendrikus Jan; Dinjens, Winand N. M. (2010). "A review on the molecular diagnostics of Lynch syndrome: a central role for the pathology laboratory". Journal of Cellular and Molecular Medicine (İngilizce). 14 (1-2): 181-197. doi:10.1111/j.1582-4934.2009.00977.x. ISSN 1582-4934. PMC 3837620 $2. PMID 19929944. 24 Haziran 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Haziran 2021.
- ^ Shrimpton, Antony E. (1 Mayıs 2002). "Molecular diagnosis of cystic fibrosis". Expert Review of Molecular Diagnostics. 2 (3): 240-256. doi:10.1586/14737159.2.3.240. ISSN 1473-7159.
- ^ Andorno, R. (1 Ekim 2004). "The right not to know: an autonomy based approach". Journal of Medical Ethics (İngilizce). 30 (5): 435-439. doi:10.1136/jme.2002.001578. ISSN 0306-6800. PMID 15467071. 24 Haziran 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Haziran 2021.
- ^ a b c d e f g h i j k l m n o "Moleküler Test | Özel Viromed Laboratuvarları". viromed.com.tr. 2 Ekim 2020 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Haziran 2021.