
Elektron dizilimi, atom fiziği ve kuantum kimyasında, bir atom ya da molekülün elektronlarının atomik ya da moleküler orbitallerdeki dağılımıdır. Örneğin Neon atomunun elektron dizilimi 1s2 2s2 2p6 olarak gösterilir.

Nanoteknoloji, maddenin atomik, moleküler ayrıca supramoleküler seviyede kontrolüdür.
Bant teorisi, bir katıdaki elektronların davranışını tanımlar. Bu teoriye göre katıda elektronlar tarafından doldurulacak sürekli enerji bantları ve elektronların bulunamayacağı enerji aralıkları bulunur. Teori elektriksel direnç ve optik absorpsiyon gibi birçok olayı açıklamada büyük yarar sağlar.

Bir kimyasal bileşiğin molekül kütlesi, bu bileşiğin bir molekülünün birleşik atom kütle birimi u cinsinden kütlesidir. Bağıl bir değer olduğundan bir maddenin molekül kütlesine yaygın olarak bağıl moleküler kütle denir ve Mr. diye de kısaltılır.

Quaregna ve Cerrato Kontu Lorenzo Romano Amedeo Carlo Avogadro, İtalyan kimyager ve bilim insanıdır. Günümüzde, adı, derişim teorisi ve moleküler ağırlık alanındaki katkılarıyla anılır.

Kimyasal bileşik, kimyasal bağlarla bir arada tutulan birden fazla kimyasal elementin atomlarını içeren birçok özdeş molekülden oluşan kimyasal maddedir. Dolayısıyla tek bir elementin atomlarından oluşan bir molekül bileşik değildir. Bir bileşik, diğer maddelerle etkileşimi içerebilen kimyasal reaksiyonla farklı bir maddeye dönüştürülebilir. Bu süreçte atomlar arasındaki bağlar kırılabilir ve/veya yeni bağlar oluşabilir.

Sör John Edward Lennard-Jones İngiliz bir matematikçi ve Bristol Üniversitesi'nde teorik fizik ve ardından Cambridge Üniversitesi'nde teorik bilim profesörü idi. Modern hesaplamalı kimyanın, günümüz sayısal kimya alanının kurucusu olarak kabul edilebilir.

Floresans, soğuk cisimlerde moleküler fotonun yutulmasının daha uzun bir dalga boyunda diğer bir fotonun yayılmasını tetiklemesiyle gerçekleşen ışık verme (ışıma) olayıdır. Yutulan ve yayılan fotonlar arasındaki enerji farkı moleküler titreşimler ya da ısı olarak ortaya çıkar.
Atom fiziği, atomu bir bütün olarak atomların etkileşimlerini, atomun ve moleküllerin yapısı, enerji düzeyleri, dalga fonksiyonlari ve elektromanyetik geçişleri, atomlar arası bağlar, moleküler yapılar, atom modeli, atomik spektroskopide ince yapı ve aşırı ince yapı, spektroskopik gösterim ve enerji seviyeleri, geçiş olasılığı ve seçim kuralları, Zeeman olayı, Stark olayı, moleküler spektrum, iyonik bağlar, dönme, titreşim ve elektronik geçiş spektrumu, lazer gibi bölümleri- inceleyen fiziğin alt dallarından ikincisidir.
Moleküler orbital teorisi, atomik orbitallerin birbirleri ile etkileşimlerini ve bunun sonucu olarak molekül orbitallerin oluşumu üzerine kurulan ve özellikle kovalent bağları açıklamada oldukça başarılı olan bir teoridir. Kuantum fiziğinden yararlanarak orbitallerin hangi durumlarda bağ oluşturacaklarını veya oluşturamayacaklarını açıklamaya çalışır.
Kuantum mekaniğine göre atomik orbital, elektronların atom çekirdeği etrafındaki konumunu ve dalga-benzeri özelliklerini tanımlayan bir matematiksel fonksiyondur. Elektronun atom çekirdeği etrafındaki belirli bir bölgede bulunma olasılığı bu fonksiyon aracılığı ile hesaplanabilir. Fizikte atomik, kimyada orbital olarak geçer.
Robert Sanderson Mulliken moleküler orbital kuramının, başka bir deyişle moleküllerin yapısının hesaplanmasının moleküler orbital yöntemiyle detaylandırılması, gelişmesini sağlayan Amerikalı fizikçi ve kimyacı. Dr Mulliken 1966 yılında kimya dalında Nobel Ödülü'nü almıştır. 1983 yılında ise Priestley Madalyasını almıştır.
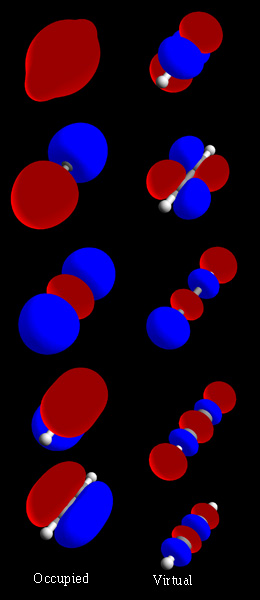
Kimyada moleküler orbital, bir molekül içindeki elektronların dalga benzeri davranışını tanımlayan matematiksel işlevdir. Molekülün herhangi bir bölümünde bir elektron bulma olasılığı gibi kimyasal ve fiziksel özellikleri hesaplamaya yarar.
Atomik, moleküler ve optik fizik, bir ya da birkaç atomun ölçeğinde, madde-madde ve ışık-madde etkileşimi çalışmadır ve enerji, birkaç elektron voltları etrafında ölçeklenir. Üç alanla yakından ilişkilidir. AMO teorisi, klasik, yarı klasik ve kuantum işlemlerini kapsar. Tipik olarak, teori ve emisyon uygulamaları, elektromanyetik yayılım ve emilme, spektroskopi analizi, lazer ve mazerlerin kuşağı ve genel olarak maddenin optik özellikleri, uyarılmış atom ve moleküllerden, bu kategorilere ayrılır.
Hesaplamalı kimya, kimya problemlerini çözmeye yardımcı olmak için bilgisayar simülasyonunu kullanan bir kimya dalıdır. Moleküllerin, katıların yapı ve özelliklerini hesaplamak için verimli bilgisayar programlarına dahil edilmiş teorik kimya yöntemlerini kullanır. Bu yöntemlerin kullanılmasının nedeni, hidrojen moleküler iyonu ile ilgili nispeten yeni sonuçlar dışında, kuantum çok-gövdeli(many-body) problemlerin analitik olarak çözülemez oluşudur. Hesaplama sonuçları normal olarak kimyasal deneylerle elde edilen bilgileri tamamlarken, bazı durumlarda gözlemlenmeyen kimyasal olayları da tahmin edebilmektedir. Yeni ilaç ve materyallerin tasarımında yaygın olarak kullanılmaktadır.

Yöresizleşmiş elektronlar veya delokalize elektronlar bir katı metal, iyon veya molekülde bulunan elektronların tek bir atom veya kovalent bağ ile ilişkili olmamasını tanımlar.

Spartan, Wavefunction'ın moleküler modelleme ve bilgisayarlı kimya uygulamasıdır. Moleküler mekanik, yarı-ampirik yöntemler, ab initio modeller, yoğunluklu fonksiyonel modeller, post Hartree-Fock modeller, G3 (MP2) ve T1 içeren termokimyasal tarifler için kodlar içerir.
Kimyasal tür, aynı moleküler enerji seviyelerini karakteristik veya belirlenmiş bir zaman ölçeğinde keşfedebilen, kimyasal olarak özdeş moleküler varlıklardan oluşan kimyasal bir madde veya topluluktur. Bu enerji seviyeleri, kimyasal türlerin diğerleriyle etkileşime girme şeklini belirler. Türler atom, molekül, iyon, radikal olabilir ve kimyasal bir adı ve kimyasal formülü vardır. Terim aynı zamanda katı bir dizide kimyasal olarak özdeş atomik veya moleküler yapı birimleri kümesine de uygulanır.

Kimyasal yapının belirlemesi, bir kimyagerin hedef molekülün moleküler geometrisini ve -uygun ve gerekli olduğunda- elektronik yapısını belirlemesini içerir. Moleküler geometri, bir moleküldeki atomların uzamsal düzenini ve atomları bir arada tutan kimyasal bağları ifade eder ve yapısal formüller ile moleküler modeller kullanılarak temsil edilebilir; eksiksiz elektronik yapı açıklamaları, bir molekülün moleküler orbitallerinin konumunun belirlenmesini içerir. Yapı belirleme, çok basit moleküllerden çok karmaşık olanlara kadar bir dizi hedefe uygulanabilir.
Kimyada, elektron verici, elektronları başka bir bileşiğe veren kimyasal oluşumlardır. Verdiği elektronlar sayesinde süreç içinde oksitlenen bir indirgeyici maddedir.










