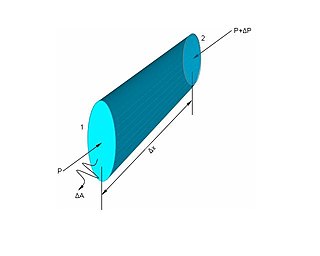
Basınç, bir yüzey üzerine etkide bulunan dik kuvvetin, birim alana düşen miktarı. Katı, sıvı ve gazlar ağırlıkları nedeniyle bulundukları yüzeye bir kuvvet uygularlar. Kuvvetin kaynağı ne olursa olsun birim yüzeye dik olarak etki eden kuvvete basınç (P), bütün yüzeye dik olarak etki eden kuvvete de basınç kuvveti (F) denir.
Derişim, bir çözeltideki çözünmüş madde miktarını incelemek için kullanılan bir kimya terimidir.

İdeal gaz yasası, sadece teoride olan ideal gazların durumları hakkında denklemler sağlayan bir yasadır. Bir miktar gazın durumu; basıncı, hacmi ve sıcaklığına göre belli olur. Bu denklem aşağıdaki gibidir:

- P paskal olarak basınç,
- V kübik metre olarak hacim,
- n gazın mol sayısı,
- R gaz sabiti
- T Kelvin olarak sıcaklık
Faraday sabiti fizik ve kimyada, bir mol elektronun sahip olduğu elektrik yükü olarak tanımlanır. Bu ad, İngiliz bilim insanı Michael Faraday'ın adına ithafen verilmiştir. Elektrolitik sistemlerde, elektrot yüzeyinde toplanan kimyasal madde miktarını hesaplamada kullanılır.
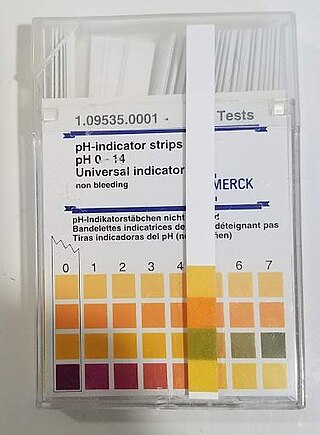
pH, bir çözeltinin asitlik veya bazlık derecesini tarif eden ölçü birimidir. pH'in açılımının ne olduğu kesin olarak bilinmese de genellikle "potential of hydrogen" veya "power of hydrogen" olduğu varsayılır.

Bir kimyasal bileşiğin molekül kütlesi, bu bileşiğin bir molekülünün birleşik atom kütle birimi u cinsinden kütlesidir. Bağıl bir değer olduğundan bir maddenin molekül kütlesine yaygın olarak bağıl moleküler kütle denir ve Mr. diye de kısaltılır.

Avogadro sayısı kadar atom ya da molekül içeren maddeye 1 mol denir. Mol, hiçbir zaman belli bir kütleyi ifade etmez.

Kimya'da, hidrojen bağı öncelikle daha elektronegatif bir "verici" atom veya gruba (Dn) kovalent bağla bağlanan bir hidrojen (H) atomu ile ve yalnız bir çift elektron taşıyan başka bir elektronegatif atom arasındaki elektrostatik çekim kuvvetidir.
Elektrokimya, kimya biliminin bir alt dalı olup elektronik bir iletken ile iyonik bir iletken (elektrolit) arayüzeyinde gerçekleşen reaksiyonları inceler. Elektrokimyada amaç kimyasal enerji ve elektrik enerjisi arasındaki değişimi incelemektir.

Fizikte, uzaydaki ağırlığın dağılımının ağırlık merkezi, birbirlerine göre olan ağırlıkların toplamlarının sıfır olduğu noktadır. Ağırlık dağılımı, ağırlık merkezi etrafında dengelenir ve dağılan ağırlığın kütle pozisyon koordinatlarının ortalaması onun koordinatlarını tanımlar. Ağırlık merkezine göre formüle edildiği zaman mekanikte hesaplamalar basitleşir.
Volumetri analit ile reaksiyona girmek üzere ilave edilen bir titrantın stokiyonetrik olarak fazlası için gerekli ikinci titranı miktarının bulunması işlemidir.

Atomik kütle birimi (sembolü akb) veya dalton (sembolü Da), çok ufak kütleli maddelerin, özellikle atom ve moleküllerin kütlelerini hesaplamak için kullanılan ölçü birimidir. Bir karbon12 (C12) atomunun kütlesinin tam olarak 1/12'sine eşittir. Bunun sebebi, karbonun en kararlı ve en kolay bulunabilen elementlerden biri olmasıdır.
Kinetik teori veya gazların kinetik teorisi, gazların basınç, sıcaklık, hacim gibi makroskobik özelliklerini moleküler bileşim ve hareketlerine bağlı olarak açıklayan teoridir. Esas olarak, teori Isaac Newton'un kanısının tersine basıncın moleküller arası statik itmeden kaynaklanmadığını, bunun yerine belli hızlarda hareket eden moleküller arası çarpışmalardan kaynaklandığını söyler. Kinetik teori aynı zamanda kinetik-moleküler teori veya çarpışma teorisi olarak da bilinir.
Sürüklenme hızı, bir parçacığın -elektron gibi- elektrik alandan dolayı ulaştığı ortalama hızdır. Ayrıca, parçacıkların hareketlerinin tanımlandığı düzlemden dolayı eksen ile ilgili sürüklenme hızına da karşılık gelebilir. Genel olarak, bir elektron bir iletken içinde Fermi hızında tıkırdayacaktır. Bir elektrik alan uygulaması bu rastgele hareketi tek bir yönde küçük bir hızla verecektir.
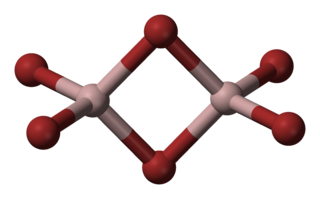
Alüminyum bromür veya diğer adıyla alüminyum tribromür, içinde alüminyum ve brom bulunan, kimyasal formülü AlBr3 veya Al2Br6 olan kimyasal birleşik Mol kütlesi 374,8 gram, erime noktası 97 °C, kaynama noktası 255 °C, yoğunluğu 3,01 g/mL olan suda çözünebilen bir maddedir. Sentezlerde açilleme katalizörü olarak kullanılan, beyazdan sarıya değişen renkte, nem çekici, kristal yapıda bir maddedir. Havada kuvvetle dumanlanır, suyla şiddetle birleşir. Organik çözücülerde çözünür. Dimer biçiminde de bulunur (Al2Br6).

Arsenöz asit (veya arsenik oksit), H3AsO3 formülüne sahip bir inorganik bileşiktir. Sulu çözeltilerde meydana geldiği bilinmektedir, ancak bu gerçek As(OH)3'ün öneminden uzaklaşmasa da saf bir malzeme olarak izole edilmemiştir.
Elektrokimyada Nernst denklemi, bir elektrokimyasal reaksiyonun indirgenme potansiyelini ; indirgeme ve oksidasyona uğrayan kimyasal türlerin standart elektrot potansiyeli, sıcaklığı ve aktiflikleri ile ilişkilendiren bir denklemdir. Denklemi formüle eden Alman fiziksel kimyacı Walther Nernst'in adını almıştır.

Madde miktarı, kimya alanında içindeki ayrı atomik ölçekli parçacıkların sayısının Avogadro sabiti NA'ya bölümü olarak tanımlanmaktadır. Özetle atomik görüşte, madde miktarı, maddeyi oluşturan parçacıkların sayısıdır. Parçacıklar veya maddeler, bağlama bağlı olarak moleküller, atomik, iyonik, elektron veya başka bir yapıda bulunabilmektedirler. Avogadro sabiti NA'nın değeri 6.02214076×1023 mol−1 olarak tanımlanmaktadır. Gerçek atomik görünümde, maddenin 1 molü, 6.02214076×1023 adet (Avogadro sayısı kadar) parçacık içermektedir. Madde miktarı, kimyasal miktar olarak da adlandırılmaktadır.
Daha yaygın ismiyle Goldman denklemi olarak bilinen Goldman-Hodgkin-Katzl denklemi, hücre zarıfizyolojisinde, hücre zarından geçen tüm iyonları hesaba katarak hücre zarındaki ters potansiyeli belirlemek için kullanılır.
Şövalye Demir Haçı veya daha çok bilinen adıyla Şövalye Haçı, diğer varyantları ile Nazi Almanyası'nın II. Dünya Savaşı sırasında askerî ve yarı askerî personeline verdiği en üst ödüldü. Şövalye Haçı; savaşta askerlerine başarılı bir şekilde liderlik yapan üst düzey bir komutandan, askerî alanda gösterdiği tek bir cesaret eylemi için düşük rütbeli bir askere kadar, çeşitli nedenler ile ve tüm rütbelere veriliyordu. 30 Eylül 1939'daki ilk sunum ile 17 Haziran 1945'teki son verilme arasında toplam 7.321 farklı ödüllendirme yapıldı. Bu sayı, Şövalye Haçı Sahipleri Derneği'nin kabul ettiği ödüllendirmelere dayalıdır. Ödül, Wehrmacht komutası altındaki üç kuvvetin yanında Waffen-SS, Reichsarbeitsdienst ve Volkssturm üyelerine verildi. Buna ek olarak Üçüncü Reich'in müttefiklerinin askerî kuvvetlerinde de 43 Şövalye Haçı sahibi vardı.










