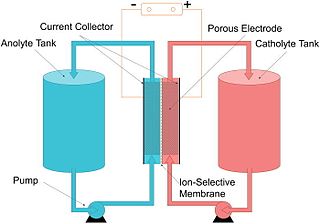
Metal-hava elektrokimyasal hücre
Metal-hava elektrokimyasal hücre, saf metalden yapılmış bir anod ve çevre havasının harici bir katodunu, tipik olarak bir sulu elektrolit ile kullanan bir elektrokimyasal hücredir.[1]

Türleri
4Li + O2 → 2Li2O'ya göre Li ve oksijen Li2O arasındaki Li-hava aküsü deşarj reaksiyonu 2.91 V'luk bir açık devre voltajına ve kilogram başına 5.210 watt-saatlik bir teorik spesifik enerjiye (Wh / kg) sahiptir. Oksijen aküde depolanmadığından, oksijen hariç teorik spesifik enerji 11.140 Wh / kg (40.1 MJ / kg) 'dır.
| Metal–air battery | Teorik spesifik enerji, Wh/kg (Oksijen dahil olmak üzere) | Teorik spesifik enerji, Wh/kg (Oksijen hariç) | Hesaplanan açık devre voltajı, V |
|---|---|---|---|
| Alüminyum pili | 4300[2] | 8140[3] | 1.2 |
| Germanyum–air | 1480 | 7850 | 1 |
| Kalsiyum-air | 2990 | 4180 | 3.12 |
| Demir–air | 1431 | 2044 | 1.3 |
| Lityum–hava pili | 5210 | 11140 | 2.91 |
| Magnezyum pili | 2789 | 6462 | 2.93 |
| Potasyum iyon pili | 935[4][5] | 1700[Note 1] | 2.48[4][5] |
| Sodyum–air | 1677 | 2260 | 2.3[6][7] |
| Silikon hava pili | 4217 | 9036 | 1.6 |
| Kalay–air 1000 K [8] | 860 | 6250 | 0.95 |
| Çinko-hava pili | 1090 | 1350 | 1.65 |
Demir-hava
Demir-hava şarj edilebilir piller, şebeke ölçekli enerji depolama potansiyeline sahip çekici bir teknolojidir. Bu teknolojinin temel hammaddesi, zengin, toksik olmayan, ucuz ve çevre dostu, demir oksittir (pas). Geliştirilen çoğu pil şu anda Fe / FeO indirgeme / oksidasyon (redoks) reaksiyonu (Fe + H2O = FeO + H2) yoluyla hidrojen üretmek / depolamak için demir oksidi (çoğunlukla tozlar) kullanmaktadır.[9] Bir yakıt hücresi ile bağlantılı olarak, sistemin, elektrik üretimi / tüketimi yoluyla H2O / H2 oluşturan şarj edilebilir bir pil gibi davranmasını sağlar. Ayrıca, bu teknoloji, aralıklı güneş ve rüzgar enerjisi kaynaklarının enerjisini depolamak, düşük karbon dioksit emisyonları ile bir enerji sistemi geliştirmek için kullanılabileceğinden, çevre üzerinde en az etkiye sahiptir.[10]
Sistemin çalışması Fe / FeO redoks tepkimesiyle başlayabilir, daha sonra demir oksidasyonu sırasında oluşan hidrojen bir yakıt hücresi tarafından, havadaki oksijen ile birlikte elektrik üretmek üzere tüketilebilir. Elektrik depolandığında, yakıt hücresinin tersine çalıştırılarak sudan üretilen hidrojen, demir oksidin metalik demir ile indirgendiği sırada tüketilir.[11] Bu döngülerin her ikisinin kombinasyonu, sistemi demir hava şarj edilebilir bir pil gibi çalıştıran şeydir.
Bu teknolojinin sınırlamaları kullanılan malzemelerden gelmektedir. Genellikle, demir oksit toz yatakları seçilir, bununla birlikte tozların hızlı sinterlenmesi ve toz haline getirilmesi, yüksek sayıda döngü elde etme kabiliyetini sınırlar ve böylece daha düşük bir kapasite elde edilir.[12] Halen araştırılmakta olan 3D-Baskı ve dondurma dökümü gibi diğer yöntemler, redoks reaksiyonu sırasında yüksek yüzey alanı ve hacim değişiklikleri için mimari materyallerin oluşturulmasını mümkün kılmaya çalışmaktadır.
Ayrıca bakınız
- Lityum-sülfür batarya
Notlar
- ^ Calculated from the specific energy density (including oxygen) value and 39.1 and 16 atomic weight data for K and O respectively for KO2
Kaynakça
- ^ "Arşivlenmiş kopya". 27 Aralık 2010 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Aralık 2010.
- ^ "Electrically Rechargeable Metal-Air Batteries (ERMAB)". 3 Mart 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 25 Mart 2012.
- ^ "Batteries for Oxygen Concentrators". 14 Şubat 2013 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Mayıs 2017.
- ^ a b "A Low-Overpotential Potassium−Oxygen Battery Based on Potassium Superoxide". 13 Haziran 2016 tarihinde kaynağından arşivlendi.
- ^ a b "A Low-Overpotential Potassium−Oxygen Battery Based on Potassium Superoxide". 21 Mayıs 2017 tarihinde kaynağından arşivlendi.
- ^ "Electrochemical properties of room temperature sodium–air batteries with non-aqueous electrolyte". Electrochemistry Communications. Cilt 16. ss. 22-25. doi:10.1016/j.elecom.2011.12.019. 24 Eylül 2015 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Mayıs 2017.
- ^ "BASF investigating sodium-air batteries as alternative to Li-air; patent application filed with USPTO". 2 Şubat 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Mayıs 2017.
- ^ HyungKuk Ju and Jaeyoung Lee*, High-temperature liquid Sn-air energy storage cell, Journal of Energy Chemistry, 24 (2015) 614.
- ^ "Arşivlenmiş kopya" (PDF). 28 Ocak 2017 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 28 Mayıs 2017.
- ^ "Arşivlenmiş kopya". 12 Mayıs 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Mayıs 2017.
- ^ "Arşivlenmiş kopya". 10 Mayıs 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Mayıs 2017.
- ^ "Arşivlenmiş kopya". 10 Mayıs 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 28 Mayıs 2017.