
Kral suyu, asitlerin az etki ettiği ya da etki etmediği altın ve platin gibi metallerle tepkimeye girebilen kuvvetli bir asit çözeltisidir. Hidroklorik asit ve nitrik asitin 3:1 oranında karıştırılmasıyla oluşur. Ebu Musa Câbir bin Hayyan tarafından bulunduğu tahmin edilmektedir.

Potasyum nitrat, formülü KNO3 olan bir potasyum bileşiğidir. Güherçile olarak da bilinen bileşik doğal hâlde kayaçlarda ve mağaralarda oluşan beyaz renkli kabuksu yapıda bulunur.
Nitrik asit, HNO3 kimyasal formülüne sahip oldukça aşındırıcı bir inorganik asittir. Kezzap olarak da bilinir. Saf hâldeki bileşik renksizdir. Ancak uzun süre bekleyen eski asitler azot oksitleri ve suya ayrışması nedeniyle sarı renge dönebilme özelliğindedirler. Piyasada bulunan nitrik asitlerin çoğu % 68'lik bir konsantrasyona sahiptir. Çözelti, %86'dan fazla HNO3 içerdiğinde, dumanlı nitrik asit olarak adlandırılır. Mevcut azot dioksit miktarına bağlı olarak, dumanlı nitrik asit ayrıca %86’nın üzerindeki konsantrasyonlarda kırmızı dumanlı nitrik asit veya %95’in üzerindeki konsantrasyonlarda beyaz dumanlı nitrik asit olarak tanımlanır.
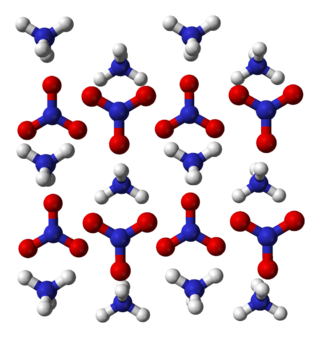
Amonyum nitrat, amonyum ve nitrat iyonlarından oluşan, NH4NO3 formülüne sahip yüksek patlayıcı bir kimyasal bileşiktir. Higroskopik özellikte ve beyaz kristal bir katı olarak hidrat oluşturmasa da suda çok çözünür. Ağırlıklı olarak, tarımda yüksek azotlu gübre olarak kullanılmaktadır. 2017 yılında küresel üretimi 21.6 milyon ton olarak tahmin edildi.

Sodyum nitrat formülü NaNO3 olan kimyasal bileşiktir. Güherçile'den ayırmak için Şili güherçilesi (bu ülkede büyük miktarda yığınlar halinde bulunması nedeniyle bu ad verilmiştir) adı da verilen bu beyaz renkli kristal tuz, potasyum nitrata oranla suda çok fazla çözünmektedir. Havadan nem çeker.

Çinko nitrat, formülü Zn(NO3)2 olan bir çinko bileşiğidir. Bu beyaz, kristal katı bileşik havadan çok nem çekerek sulanır ve genellikle hekzahidrat Zn(NO3)2•6H2O formunda bulunmaktadır. Çinko nitrat su ve alkolde çözünür.

Azot triklorür, trikloramin olarak da bilinen formülü NCl3 olan kimyasal bileşik. Sarı, yağımsı, keskin kokulu bir sıvıdır. En sık amonyak türevleri ve klor arasındaki kimyasal reaksiyon sonrası oluşmaktadır, yüzme havuzlarındaki oluşumu buna bir örnektir.

Gümüş klorat (AgClO3) beyaz tetragonal kristaller formundadır. Tüm kloratlar gibi suda çözünür ve oksitleyici bir maddedir. Basit bir metal tuzu olarak, temel inorganik kimya deneylerinde kullanılan yaygın bir kimyasaldır. Işığa duyarlıdır, bundan dolayı oldukça koyu renkli kapalı kaplarda saklanmalıdır.
İyot pentafluorür, IF5 kimyasal formülüne sahip florür ve iyottan oluşan bir interhalojen bileşiktir. 3.250 g cm−3 yoğunluğa sahip, renksiz veya sarı bir sıvıdır. İlk olarak 1891'de Henri Moissan tarafından flor gazı içinde katı iyot yakılarak sentezlendi. Bu ekzotermik reaksiyon, reaksiyon koşulları iyileştirilmiş olmasına rağmen hala iyot pentaflorür üretmek için kullanılır. I2 + 5 F2 → 2 IF5

Enantiyoselektif sentez ya da asimetrik sentez, bir kimyasal sentez şeklidir. IUPAC, bir veya daha fazla yeni kiralite elementinin bir substrat molekülünde oluşturulduğu ve stereoizomerik ürünleri eşit olmayan miktarlarda üreten kimyasal reaksiyon olarak tanımlanır.
Organik kimyada sikloalkin, bir alkinin siklik analoğudur. Bir sikloalkin, bir veya daha fazla üçlü bağ içeren, kapalı bir karbon atomu halkasından oluşur. Sikloalkinlerin genel formülü CnH2n-4 tür. C–C≡C–C alkin biriminin doğrusal doğası nedeniyle, sikloalkinler yüksek oranda zorlanabilir. Yalnızca, halkadaki karbon atomlarının sayısı, bu geometriyi karşılamak için gerekli esnekliği sağlayacak kadar fazla olduğunda mevcut olabilir. Bu molekül sınıfının en küçük bileşenleri deneysel olarak gözlemlenemeyecek kadar çok zorlanma yaşayabilirken, büyük alkin içeren karbosikllerde zorlanma gözlenmez. Siklooktin (C8H12), izole edilebilen ve stabil bir bileşik olarak depolanabilen en küçük sikloalkin grubudur. Bununla birlikte, daha küçük sikloalkinler, diğer organik moleküller ile reaksiyonlar yoluyla veya geçiş metallerine kompleksleşme yoluyla üretilebilir ve hapsedilebilir.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.

Bakır (II) nitrat Cu(NO3)2(H2O)x formülüne sahip inorganik bileşikler ailesinin herhangi bir üyesini tanımlar. Hidratlar mavi katılardır. Susuz bakır nitrat mavi-yeşil kristaller oluşturur ve 150-200 °C'de vakumda süblimleşir. Yaygın hidratlar hemipentahidrat ve trihidrattır.
Nitrolama bir nitro grubunun organik kimyasal bileşik içine sokulması için genel bir kimyasal proses sınıfıdır. İfade daha genel olarak, ayrıca nitrogliserin sentezinde olduğu gibi alkoller ve nitrik asit arasında farklı nitrat esterleri oluşturma işlemine yanlış olarak uygulanır. Nitro bileşiklerinin ve nitratların ortaya çıkan yapısı arasındaki fark nitro bileşiklerindeki azot atomunun doğrudan oksijen olmayan bir atoma genel olarak da karbon veya başka azot atomuna bağlanmasıdır. Oysaki organik nitratlar olarak da adlandırılan nitrat esterlerinde, azot bir oksijen atomuna genellikle dolayısıyla da bir karbon atomu 'na bağlanır.

N-nitroüre, 1-nitroüre ve N-nitrokarbamid olarak da bilinen Nitroüre, ürenin nitrolaması veya üre nitratın dehidrasyon reaksiyonu yoluyla sentezlenen oldukça patlayıcı bir bileşiktir.

Magnezyum nitrat Mg(NO3)2(H2O)x formülüne sahip inorganik bileşikleri ifade eder. Formüldeki, x = 6, 2 ve 0 olabilir. Hepsi beyaz renkli katılardır. Susuz madde higroskopiktir, havada bekletildiğinde hızlı bir şekilde hekzahidrat oluşturur. Bütün tuzları hem suda hem de etanolde çok çözünür.

Nitro bileşikleri, bir veya daha fazla nitro fonksiyonel grubu (−NO2) içeren organik bileşiklerdir. Nitro grubu, dünya çapında kullanılan en yaygın eksplosoforlardan (bileşiği patlayıcı madde yapan fonksiyonel grup) biridir. Nitro grubuda güçlü bir elektron çeken gruptur. Bu özellik nedeniyle, nitro grubuna alfa (bitişik) olan C-H bağları asidik olabilir. Aynı nedenden dolayı, aromatik bileşiklerde nitro grubunun varlığı elektrofilik aromatik sübstitüsyonu yavaşlatsa da nükleofilik aromatik sübstitüsyonu kolaylaştırır. Nitro grupları, doğada nadiren bulunur ve nitrik asit ile başlayan nitrolama reaksiyonları tarafından neredeyse her zaman üretilir.

Organokataliz, organik bir katalizörle birlikte kimyasal reaksiyon hızının arttığı bir kataliz türüdür. Bu organokatalizörler; karbon, hidrojen, kükürt ve organik bileşiklerde yer alan diğer ametaller olabilirler.
Biyosentez, substratların canlı organizmalarda daha karmaşık ürünlere dönüştürüldüğü çok aşamalı, enzim katalizli bir süreçtir. Biyosentezde basit bileşikler modifiye edilir, diğer bileşiklere dönüştürülür veya makromoleküller oluşturmak üzere birleştirilir. Bu süreç genellikle metabolik yollardan oluşur. Bu biyosentetik yollardan bazıları tek bir hücresel organel içinde yer alırken diğerleri birden fazla hücresel organel içinde yer alan enzimleri içerir. Bu biyosentetik yolların örnekleri arasında çift katlı lipit katmanının bileşenlerinin ve nükleotidlerin üretimi yer alır. Biyosentez genellikle anabolizma ile eş anlamlıdır ve bazı durumlarda birbirinin yerine kullanılır.

4-Nitroklorobenzen ClC6H4NO2 formülüne sahip bir organik bileşiktir. Soluk sarı renkte bir katıdır. 4-Nitroklorobenzen, lastikte bulunan yaygın antioksidanlar da dahil olmak üzere endüstriyel olarak kullanılan bir dizi bileşiğin üretiminde yaygın bir ara maddedir. ClC6H4NO2 formülüne sahip diğer izomerler arasında 2-nitroklorobenzen ve 3-nitroklorobenzen bulunur.















