
Enstrümental analiz, analitleri bilimsel aletler (enstrümanlar) kullanarak inceleyen analitik kimya alanı.

Kütle spektrometrisi, İngilizce: Mass spectrometry (MS), kimyasal türleri iyonize edip oluşan iyonları Kütle-yük oranını esas alarak sıralayan bir analitik teknik. Daha basit terimler ile, bir kütle spektrumu bir numunen içindeki kütleleri ölçer. Kütle spektrometrisi birçok farklı alanda kullanılır ve kompleks karışımlara uygulandığı kadar saf numunelere de uygulanır.

Elektrosprey iyonizasyon, bir aerosol oluşturmak için bir sıvıya yüksek voltajın uygulandığı bir elektrosprey kullanarak iyon üretmek için kütle spektrometresinde kullanılan bir tekniktir. Özellikle makromoleküllerden iyon üretiminde faydalıdır çünkü iyonize edildiğinde bu moleküllerin parçalanma eğiliminin üstesinden gelir.
Yumuşak lazer desorpsiyonu, fragmantasyon olmaksızın iyonizasyona neden olan büyük moleküllerin lazer desorpsiyonudur. İyon oluşumu bağlamında "yumuşak", kimyasal bağları koparmadan iyon oluşturmak anlamına gelir. "Sert" iyonlaşma, bağların kırılmasıyla iyonların oluşması ve fragman iyonlarının oluşmasıdır.

Elektron iyonizasyonu, enerjik elektronların iyonlar üretmek için katı veya gaz fazı atomları veya molekülleri ile etkileşime girdiği bir iyonizasyon yöntemidir. EI, kütle spektrometrisi için geliştirilen ilk iyonizasyon tekniklerinden biriydi. Ancak bu yöntem hala popüler bir iyonizasyon tekniğidir. Bu teknik, iyonları üretmek için yüksek enerjili elektronlar kullandığı için sert bir iyonizasyon yöntemi olarak kabul edilir. Bu, bilinmeyen bileşiklerin yapı tespiti için yardımcı olabilecek kapsamlı parçalanmaya yol açar. EI, moleküler ağırlığı 600'ün altında olan organik bileşikler için en yararlı olanıdır. Aynı zamanda, katı, sıvı ve gaz halindeki birkaç başka termal olarak kararlı ve uçucu bileşik, çeşitli ayırma yöntemleriyle birleştirildiğinde bu tekniğin kullanılmasıyla tespit edilebilir.

Kimyasal iyonizasyon, kütle spektrometresinde kullanılan yumuşak bir iyonizasyon tekniğidir. İlk olarak Burnaby Munson ve Frank H. Field tarafından 1966'da tanıtıldı. Bu teknik, gaz iyon molekülü kimyasının bir dalıdır. Reaktif gaz molekülleri elektron iyonizasyonu ile iyonize edilir ve bunu takiben iyonlaşmayı sağlamak için gaz fazındaki analit molekülleri ile reaksiyona girerler. Negatif kimyasal iyonizasyon, yük değişimli kimyasal iyonizasyon ve atmosferik basınçlı kimyasal iyonizasyon, bu tekniğin yaygın varyasyonlarından bazılarıdır. CI, organik bileşiklerin tanımlanması, yapılarının aydınlatılması ve miktar tayininde birkaç önemli uygulamaya sahiptir. Analitik kimyadaki uygulamaların yanı sıra, kimyasal iyonizasyonun faydaları biyokimyasal, biyolojik ve tıbbi alanlara da uzanmaktadır.

Alan desorpsiyonu (Field desorption-FD) bir tıraş bıçağı gibi keskin bir yüzeye sahip bir yayıcıya veya daha yaygın olarak bir filamana yüksek potansiyelli bir elektrik alanının uygulandığı kütle spektrometrisinde (MS) kullanılan bir iyon oluşturma yöntemidir. Alan desorpsiyonu, analitin gaz halindeki moleküllerinin iyonlaşmasına neden olabilecek yüksek bir elektrik alanı ile sonuçlanır. FD tarafından üretilen kütle spektrumları çok az veya hiç parçalanmaya neden olmaz çünkü FD yumuşak bir iyonizasyon yöntemidir. Moleküler radikal katyonlar arasında genelde M+ ve daha az sıklıkla protonlanmış moleküller  baskındır. Teknik ilk olarak 1969'da Beckey tarafından bildirildi. Aynı zamanda uçucu olmayan ve termal olarak kararsız bileşikleri iyonize eden ilk iyonizasyon yöntemidir. FD' nin diğer iyonizasyon yöntemlerinden önemli bir farkı, bir numuneyi bombardıman etmek için birincil ışına ihtiyaç duymamasıdır.
baskındır. Teknik ilk olarak 1969'da Beckey tarafından bildirildi. Aynı zamanda uçucu olmayan ve termal olarak kararsız bileşikleri iyonize eden ilk iyonizasyon yöntemidir. FD' nin diğer iyonizasyon yöntemlerinden önemli bir farkı, bir numuneyi bombardıman etmek için birincil ışına ihtiyaç duymamasıdır.

Hızlı atom bombardımanı, yüksek enerjili atomlardan oluşan bir ışının iyonlar oluşturmak için bir yüzeye çarptığı kütle spektrometrisinde kullanılan bir iyonizasyon tekniğidir. Michael Barber tarafından 1980 yılında Manchester Üniversitesi'nde geliştirilmiştir. Atomlar yerine yüksek enerjili iyon demeti kullanıldığında (ikincil iyon kütle spektrometrisinde olduğu gibi, yöntem sıvı ikincil iyon kütle spektrometrisi olarak adlandırlır. FAB ve LSIMS' de analiz edilecek malzeme matris adı verilen uçucu olmayan kimyasal koruma ortamı ile karıştırılır ve yüksek enerjili atom ışınıyla vakum altında bombardımana tutulur. Atomlar tipik olarak argon veya ksenon gibi bir inert gazlardandır. Yaygın matrisler arasında gliserol, tiogliserol, 3-nitrobenzil alkol, 18-taç-6 eter, 2-nitrofeniloktil eter, sülfolan, dietanolamin ve trietanolamin bulunur. Bu teknik, ikincil iyon kütle spektrometrisi ve plazma desorpsiyon kütle spektrometrisine benzer.

Termosprey, sıvı numunenin çözücü akışının çok ince ısıtılmış bir kolondan geçerek ince sıvı damlacıklardan oluşan bir sprey haline geldiği yumuşak bir iyonizasyon kaynağıdır. Kütle spektrometrisinde atmosferik basınç iyonizasyonunun bir biçimi olarak, bu damlacıklar daha sonra bir çözücü iyon plazması oluşturmak için düşük akımlı bir deşarj elektrodu aracılığıyla iyonize edilir. Oluşan bu yüklü parçacıkları süzgeçten ve hızlandırma bölgesinden geçirilir. Ardından aerosol haline getirilmiş numuneyi bir kütle spektrometresine girer. Termosprey özellikle sıvı kromatografi-kütle spektrometrisinde (LC-MS) faydalıdır.

Protein kütle spektrometrisi, kütle spektrometrisinin proteinlerin incelenmesine uygulanmasını ifade eder. Kütle spektrometrisi, proteinlerin doğru kütle tespiti ve karakterizasyonu için önemli bir yöntemdir ve birçok kullanımı için çeşitli yöntemler ve araçlar geliştirilmiştir. Uygulamaları arasında proteinler ve translasyon sonrası modifikasyonlarının tanımlanması, protein komplekslerinin, alt birimlerinin ve fonksiyonel etkileşimlerinin aydınlatılması veproteomikteki proteinlerin küresel ölçümü yer alır. Aynı zamanda proteinlerin çeşitli organellerdeki konumlarını belirlemek ve farklı proteinler ile membran lipidleri arasındaki etkileşimleri belirlemek için de kullanılabilir.

Silikon üzerinde desorpsiyon/iyonizasyon (DIOS), kütle spektrometresi analizi için gaz fazı iyonları oluşturmak amacı ile kullanılan yumuşak bir lazer desorpsiyon yöntemidir. DIOS, ilk yüzey tabanlı yüzey destekli lazer desorpsiyon/iyonizasyon yaklaşımı olarak kabul edilir. Önceki yaklaşımlar, bir gliserol matrisinde nanopartiküller kullanılarak gerçekleştirilmiştir, DIOS ise nano yapılı bir yüzey üzerine bir numunenin biriktirildiği ve numunenin lazer ışığı enerjisinin adsorpsiyonu yoluyla nanoyapılı yüzeyden doğrudan desorbe edildiği matris içermeyen bir tekniktir. DIOS, organik molekülleri, metabolitleri, biyomolekülleri ve peptitleri analiz etmek ve nihayetinde dokuları ve hücreleri görüntülemek için kullanılmıştır.

Atmosferik basınçta kimyasal iyonizasyon (Atmospheric pressure chemical ionization-APCI), atmosferik basınçta (105 Pa) gaz fazı iyon molekülü reaksiyonlarını kullanan kütle spektrometrisinde kullanılan bir iyonizasyon yöntemidir. Yaygın olarak yüksek performanslı sıvı kromatografisi (high performance liquid chromatography-HPLC) ile kombine edilir. APCI, birincil iyonların bir çözücü sprey üzerinde üretildiği kimyasal iyonizasyona benzer bir yumuşak iyonizasyon yöntemidir. APCI'nin ana kullanımı, 1500 Da'dan daha düşük moleküler ağırlığa sahip polar ve nispeten daha az polar termal olarak kararlı bileşikler içindir.

Kütle spektrometrisinde Orbitrap, bir dış namlu benzeri elektrot ve iyonları milin etrafındaki yörünge hareketinde hapseden koaksiyel iç mil benzeri elektrottan oluşan bir iyon tuzağı kütle analizörüdür. Sıkışan iyonlardan gelen görüntü akımı tespit edilir ve frekans sinyalinin Fourier dönüşümü kullanılarak bir kütle spektrumuna dönüştürülür.
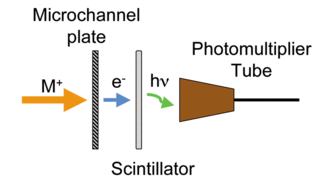
İyon-foton detektörü , kütle spektrometresinde iyonları tespit etmek için kullanılan bir bileşendir.

Bir reflektron, darbeli bir iyon kaynağı, alansız bölge, iyon aynası ve iyon dedektörü içeren ve içine giren iyonların hareket yönünü tersine çevirmek için iyon aynasında bulunan statik veya zamana bağlı bir elektrik alanı kullanan bir uçuş zamanı kütle spektrometresidir.
Kütle spektrometresi yazılımı, kütle spektrometresinde veri toplama, analizi veya temsil için kullanılan bir yazılımdır.
Üst-alt proteomik, kütle ölçümü ve ardışık kütle spektrometresi (MS/MS) analizi için izole edilmiş bir protein iyonunu depolamak üzere bir iyon yakalayıcı kütle spektrometresi veya MS/MS ile birlikte iki boyutlu jel elektroforezi gibi diğer protein saflaştırma yöntemlerini kullanan bir protein tanımlama yöntemidir. Üst-alt proteomik, yekpare haldeki proteinlerin analizi yoluyla benzersiz proteoformları tanımlama ve niceleme yeteneğine sahiptir. Kütle spektrometresi sırasında yekpare haldeki proteinler tipik olarak elektrosprey iyonizasyon ile iyonize edilir ve bir Fourier dönüşümü iyon siklotron rezonansı, kuadrupol iyon tuzağı veya Orbitrap kütle spektrometresinde tutulur. Ardışık kütle spektrometresi için parçalanma, elektron yakalama ayrışması veya elektron transfer ayrışması ile gerçekleştirilir. Etkili bir parçalanma, kütle spektrometresi tabanlı proteomikten önce numunenin işleme safyası için kritiktir. Proteom analizi rutin olarak yekpare haldeki proteinlerin sindirilmesini ve ardından kütle spektrometresi (MS) kullanılarak elde edilen protein tanımlamasını içerir. Üst-alt MS (jelsiz) proteomik, protein yapısını, yekpare haldeki bir kütlenin ölçümü ve ardından gaz fazında doğrudan iyon ayrışması yoluyla sorgular.

Lazer sprey iyonizasyonu (LSI), yüklü bir partikül yığını oluşturmak için bir nötr partikül spreyi veya ablasyon materyali ile etkileşime giren bir lazer kullanarak iyon oluşturmak için kullanılan çeşitli yöntemlerden birini ifade eder. Bu şekilde oluşan iyonlar, kütle spektrometresi ile m/z oranına göre ayrılabilir. Lazer sprey, daha büyük moleküllerin tespiti için sıvı kromatografi-kütle spektrometresi ile birleştirilebilen birkaç iyon kaynağından biridir.

Kapiler elektroforez kütle spektrometrisi (CE-MS), kapiler elektroforezin sıvı ayırma işleminin kütle spektrometresi ile birleşiminden oluşan bir analitik kimya tekniğidir. CE-MS, tek bir analizde yüksek ayırma verimliliği ve moleküler kütle bilgisi sağlamak için hem CE hem de MS'nin avantajlarını birleştirir. Yüksek çözünürlük ve hassasiyete sahiptir, minimum hacim gerektirir ve yüksek hızda analiz yapabilir. İyonlar tipik olarak elektrosprey iyonizasyonla oluşturulur ancak matris destekli lazer desorpsiyon/iyonizasyonu veya diğer iyonizasyon teknikleriyle de oluşturulabilirler. Proteomik ve biyomoleküllerin kantitatif analizinde ve klinik tıpta kullanılmaktadır. 1987'deki tanıtımından bu yana, yeni gelişmeler ve uygulamalar CE-MS'i güçlü bir ayırma ve tanımlama tekniği haline getirmiştir.
Kızılötesi çoklu foton ayrışması, genellikle orijinal (ana) molekülün yapısal analizi için gaz fazındaki molekülleri parçalamak amacıyla kütle spektrometrisinde kullanılan bir tekniktir.

















