Marcus teorisi
Marcus teorisi, ilk olarak Rudolph A. Marcus tarafından 1956'da başlayarak, elektron transfer reaksiyonlarının oranlarını açıklamak için geliştirilen bir teoridir. Bir elektronun (elektron vericisi olarak adlandırılan) bir kimyasal türden (elektron alıcısı adı verilen) bir diğerine geçişindeki oranlarla ilgilenir.[1]
Başlangıçta, iki kimyasal türün yüklerinde yalnızca bir elektron sıçramasıyla değiştiği (örneğin Fe2+/Fe3+ gibi bir iyonun oksidasyonu), ancak büyük yapısal elektron transfer reaksiyonları dışında, dış küre elektron transfer reaksiyonlarıyla oluşan değişiklikleri ele almak için formüle edilmiştir. Daha sonra genişletilerek, İki kimyasal türün çözülme veya koordinasyon kabuklarındaki uzaklık veya geometrik değişikliklerin hesaba katıldığı iç küre elektron transfer katkılarını içerecek hale getirildi. (Fe(H2O)2+ ve Fe(H2O)3+ içinde Fe-O'nun durumu farklıdır.)[2][3]
Kimyasal bağ kurulmadan veya koparmadan gerçekleşen elektron transfer reaksiyonları için Marcus teorisi, Eyring'in yapısal değişimli reaksiyonlar için türetilen geçiş durumu teorisinin[4][5] yerini aldı. Her iki teori de aynı üstel formdaki oran denklemleri ile ortaya çıkmaktadır. Bununla birlikte, Eyring teorisinde reaksiyon ortakları, yapısal olarak tanımlanmış aktive edilmiş bir kompleks oluşturmak için reaksiyon sırasında güçlü bir şekilde eşleşirken, Marcus teorisinde zayıf bir şekilde eşleşirler ve bireyselliklerini korurlar. Çevrenin, çözücünün (dış küre) ve çözücü kılıfın veya ligandların (iç küre), elektron sıçramasından önce ve ondan bağımsız olarak geometrik olarak uygun durumu yaratan, termal olarak indüklenmesiyle yeniden düzenlenir.
Tek elektronlu redoks reaksiyonu
Kimyasal reaksiyonlar, bir moleküldeki bir grubun veya bir kompleksteki bir ligandın ikamesine, bir molekül grubunun veya bir ligandın ortadan kaldırılmasına veya bir molekül veya kompleksin yeniden düzenlenmesine yol açabilir. Bununla birlikte, bir elektron transfer reaksiyonu, reaksiyona giren maddeler arasında basitçe bir yük değişimine neden olabilir ve bir bağı oluşturmadan veya kırmadan bu redoks reaksiyonları, iyonlar ve kompleksler için inorganik kimyada oldukça basit görünmektedir. Bu reaksiyonlar genellikle bir renk değişikliği ile kendini gösterir, örneğin geçiş metali iyonlarının iyonlarından biri veya kompleksleri için, ancak organik moleküller de bir elektronu alarak veya vererek renklerini değiştirebilirler. Benzer biçimde herbisit Paraquat ([(C6H7N)2]Cl2; N, N- dimetil- 4,4'-bipiridinyum diklorür) da bir elektron kabul edildiğinde maviye dönüşür, dolayısıyla metil violojen'in alternatif adıdır. Rudolph A. Marcus bu tür elektron transfer reaksiyonları için teorisini geliştirmiştir. Burada argümanın izi ve sonuçları sunulmaktadır. Matematiksel gelişim ve detaylar için orijinal makalelere başvurulmalıdır.[6]
Bir redoks reaksiyonunda, bir ortak elektron vericisi olarak D, diğeri bir alıcı A olarak hareket eder. Bir reaksiyonun gerçekleşmesi için D ve A birlikte yayılmalıdır. Prekürsör kompleksini oluştururlar, genellikle kinetik, kararsız, çözülmüş bir karşılaşma kompleksi, elektron transferiyle ardıl komplekse dönüştürülür ve son olarak bu, difüzyonla ayrılır. Tek elektron transferi için reaksiyon şöyle formüle edilir:
{D}+A <=>[k_{12}][k_{21}] [D{\dotsm}A] <=>[k_{23}][k_{32}] [D+{\dotsm}A^-] ->[k_{30}] {D+} + {A^-}</chem>
Dış küre elektron transferi
Redoks reaksiyonları için Gibbs serbest aktivasyon enerjisinin doğası ve büyüklüğü üzerinde çalışırken çözücünün rolünü, daha doğrusu, dış küre tipinin tek elektron transfer reaksiyonlarını fark eden de R. A. Marcus oldu. Konu iki temel makale yayınlandı.[6] Marcus'un sonraki çalışmaları onların çok ötesine geçse de, bu iki makalenin fikirleri genellikle Marcus Teorisine atıfta bulunulmaktadır.[1]
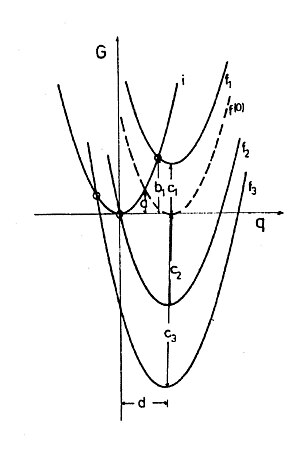
r1 ve r2 küre yarıçapları ve R, εs ve εoptik statik ve çözücü yüksek frekans (optik) dielektrik sabitleri olan, bunların ayrılması sırasında, Δ şarj miktarı, transfer e. G'ye karşı Δe'nin grafiği bir paraboldür. (Şekil 1) Marcus teorisinde, bir birim yük transferine ait (Δ E = 1) enerjinin (dış küre) yeniden düzenlenmesi (λo) olarak adlandırılır. Örneğin bir durumun enerjisi, bir birim miktarının aktarılması için uygun olan polarizasyonu, ancak transferden önceki gerçek yük dağılımıyla olu.[7] Değişim yönü açısından sistem simetriktir.
Her iki küreler aktarılacak olan şarj miktarının yarısını taşıyan birinci aşamada şarj belirli bir miktarda transferi I B enerjisi halde sistem için örneğin, hesaplanır. Sistemin bu durumuna, ilgili yükün donör küreden vakuma ve ardından tekrar alıcı küreye aktarılmasıyla ulaşılabilir.[8] Daha sonra toplam çözücü polarizasyon P u + Pe oluşturur çözücü içinde, tanımlanmış bir elektrik alanına yük vermek artış bu durumda küreleri. Aynı şekilde, çözücünün bu polarizasyonu yüklerle etkileşime girer.
Marcus teorisi
Makroskopik sistem: iki iletken küre

- Marcus, klasik, tamamen elektrostatik bir model kullanıyor. Ücret (birçok temel ücret) herhangi bir kısımda bir kurumdan diğerine aktarılabilir.
- Marcus, hızlı elektron polarizasyonu Pe'yi ve çözücünün yavaş atomunu ve yönelim polarizasyonunu Pu, çeşitli büyüklük sıralarında farklı olan zaman sabitleri temelinde ayırır.
- Marcus, iç küreyi (reaktan + kompleksler + ligandlar halinde sıkıca bağlı çözücü molekülleri) ve dış küreyi (serbest çözücü) ayırır
- Bu modelde Marcus, "geçiş durumu" nun denge dışı polarizasyonunun dış küre enerjisini hesaplamakla yetiniyor. Dış küre enerjisi, geniş kapsamlı elektrostatik kuvvetler nedeniyle genellikle iç küre katkısından çok daha büyüktür. (Debye-Hückel elektrokimya teorisini karşılaştırılabilir)
R, 1 ve r, 2 küre yarıçapları ve R, ε s ve ε tercih statik ve çözücü yüksek frekans (optik) dielektrik sabitleri olan, bunların ayrılması olduğunda, Δ şarj miktarı, transfer e. G'ye karşı Δ e'nin grafiği bir paraboldür (Şekil 1). Marcus Teorik olarak, enerji bir birim yük transferi ait Δ E = 1) yeniden düzenlenmesi enerjisi (dış alan) olarak adlandırılır λ o örneğin polarizasyon bir birim miktarının aktarılması için uygun olan bir durum enerji ücret, ancak gerçek ücret dağılımı, transferden önce.[7] Değişim yönü açısından sistem simetriktir.
Mikroskobik sistem: verici-alıcı çifti
Şu ana kadar sadece fizik alanında iken, bu noktada biraz kimya giriliyor. Kendi kendine değişim reaksiyonu çok spesifik bir redoks reaksiyonudur, redoks reaksiyonlarının çoğu farklı partnerler arasındadır.[9] Örnek:
Elektron sıçraması olasılığı
Verici ve alıcının elektronik bağlantısının gücü, elektron transfer reaksiyonunun adyabatik mi yoksa non-adyabatik mi olduğuna karar verir. Adyabatik olmayan durumda bağlantı zayıftır, yani Şekil 3'teki HAB, yeniden organizasyon enerjisine kıyasla küçüktür ve verici ile alıcı kimliklerini korur. Sistemin başlangıçtan son potansiyel enerji eğrilerine atlamak için belirli bir olasılığı vardır. Adyabatik durumda, bağlantı dikkate değerdir, 2 HAB aralığı daha büyüktür ve sistem daha düşük potansiyel enerji eğrisinde kalır.[10]
Yukarıda belirtildiği gibi Marcus teorisi, adyabatik olmayan durumu temsil eder.[11] Sonuç olarak, yarı klasik Landau-Zener teorisi uygulanabilir, bu da potansiyel enerji eğrilerinin kesişme bölgesinden sistemin tek bir geçişi için donör ve alıcının karşılıklı dönüşüm olasılığını verir.
Şekil 3'te İç ve dış kürenin yeniden düzenlenmesi ve elektronik kuplaj dahil olmak üzere Elektron Transferi için enerji diyagramı görülüyor: Dikey eksen "serbest enerji" ve yatay eksen "reaksiyon koordinatıdır". Reaksiyon koordinatı, tüm atom çekirdeğinin (dahili çözücünün yeniden düzenlenmesini sağlayan) hareketini temsil eden basitleştirilmiş bir eksendir.
Bunu çözerken, Marcus teorisinin temel denklemine ulaşılır.

Deneysel sonuçlar
R. A. Marcus teorisini 1956'da yayınladı. Uzun yıllar boyunca ters çevrilmiş bölge için yoğun bir araştırma yapıldı ve bu teorinin bir kanıtı olacaktı. Ancak, giderek daha fazla negatif ΔG0 reaksiyon serisi ile yapılan tüm deneyler, reaksiyon hızının difüzyon limitine kadar, yani her karşılaşmanın elektron transferine yol açtığını gösteren bir değere kadar ve bu limitin çok negatif ΔG0 değerleri için de geçerli olduğunu ortaya koymuştur. Buna Rehm-Weller davranışı denmiştir.[13] Donör ve alıcının sert bir ayırıcı vasıtasıyla sabit bir mesafede tutulduğu bir molekülde molekül içi elektron transferi için Miller, Calcaterra ve Closs tarafından ters çevrilmiş bölgenin kesin olarak doğrulanması yaklaşık 30 yıl sürdü. (Şekil 4)[14]
R. A. Marcus ve çalışma arkadaşları, burada özetlenen teoriyi birkaç yönden daha da geliştirdiler. Diğerlerinin yanı sıra istatistiksel yönleri ve kuantum etkilerini dahil ettiler,[15] teoriyi kemilüminesansa[6] ve elektrot reaksiyonlarına uyguladılar.[16] R. A. Marcus, 1992'de Nobel Kimya Ödülü'nü aldı ve verdiği Nobel Konferansında, çalışmalarını kapsamlı biçimde sundu.[1]
Kaynakça
- ^ a b c "Electron Transfer Reactions in Chemistry: Theory and Experiment". Nobelstiftung (İngilizce). 8 Aralık 1992. 14 Eylül 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 2 Nisan 2007.
- ^ Marcus'un yaklaşımının tersine, Noel S. Hush'ın iç küre elektron transfer teorisi, bir geometrik koordinat (adyabatik durum) boyunca transfer sırasında elektron yoğunluğunun sürekli değişimine atıfta bulunur ve ayrıca Marcus'un yaptığı gibi çözücü etkisini hesaba katar.
- ^ Hush, N.S. Trans.
- ^ P. W. Atkins: Physical Chemistry, 6.
- ^ R.S. Berry; S. A. Rice; J. Ross (1980). Physical Chemistry (İngilizce). New York: Wiley. s. 1147.
- ^ a b c Marcus, R. A. "On the Theory of Oxidation-Reduction Reactions Involving Electron Transfer I". J.Chem. (İngilizce).
- ^ a b Not: Dış küre yeniden düzenleme enerjisinin ikinci dereceden bağımlılığı, reaktanlar veya çözücüdeki titreşimlerin bir sonucu değildir!
- ^ Marcus, reaktanların vakum durumunu sıfır enerji noktası olarak alır.
- ^ Bunlar genellikle Marcus çapraz reaksiyonları olarak adlandırılır.
- ^ Bir geçiş durumu yoluyla ilerleyen ikame gibi normal kimyasal reaksiyonlarda, üst potansiyel enerji eğrisi ihmal edilecek kadar yukarıdadır.
- ^ Hush tarafından nükleer hareketin (bir elektron sıçraması değil, bir yük transferi olarak düşünülebilir) katılımıyla adyabatik elektron transferi teorisi geliştirildi.
- ^ JACS, Wikipedia'yı grafikler için lisanslamadığından orijinal belgeye başvurulması önerilir.
- ^ Rehm, D.; Weller, A. "Kinetik und Mechanismus der Elektronenübertragung bei der Fluoreszenzlöschung in Acetonitril". Ber. (Almanca).
- ^ Miller J.R.; Calcaterra L.T.; Closs G.L. Intramolecular long-distance electron transfer in radical anions (İngilizce).
- ^ Siders, P.; Marcus, R. A. "Quantum Effects in Electron-Transfer Reactions". J.Am.Chem. (İngilizce).
- ^ Marcus, R. A. On the Theory of Electron-Transfer Reaction VI (İngilizce).
Marcus'un önemli makaleleri
- Marcus, R.A (1956). "On the Theory of Oxidation-Reduction Reactions Involving Electron Transfer. I" (PDF). J. Chem. Phys. (İngilizce). 24 (5): 966-978. doi:10.1063/1.1742723. 9 Ağustos 2017 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 16 Kasım 2020.
- Marcus, R.A (1956). "Electrostatic Free Energy and Other Properties of States Having Nonequilibrium Polarization. I" (PDF). J. Chem. Phys. (İngilizce). 24 (5): 979-989. doi:10.1063/1.1742724. 24 Temmuz 2018 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 16 Kasım 2020.
- Marcus, R.A (1957). "On the Theory of Oxidation-Reduction Reactions Involving Electron Transfer. II. Applications to Data on the Rates of Isotopic Exchange Reactions" (PDF). J. Chem. Phys. 26 (4): 867-871. doi:10.1063/1.1743423. 19 Temmuz 2018 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 16 Kasım 2020.
- Marcus, R.A (1957). "On the Theory of Oxidation-Reduction Reactions Involving Electron Transfer. III. Applications to Data on the Rates of Organic Redox Reactions" (PDF). J. Chem. Phys. (İngilizce). 26 (4): 872-877. doi:10.1063/1.1743424. 25 Temmuz 2018 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 16 Kasım 2020.
- Marcus, R.A (1960). "Exchange reactions and electron transfer reactions including isotopic exchange. Theory of oxidation-reduction reactions involving electron transfer. Part 4.—A statistical-mechanical basis for treating contributions from solvent, ligands, and inert salt" (PDF). Discuss. Faraday Soc. (İngilizce). 29: 21-31. doi:10.1039/df9602900021. 2 Aralık 2017 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 16 Kasım 2020.
- Marcus, R.A (1963). "On The Theory Of Oxidation--Reduction Reactions Involving Electron Transfer. V. Comparison And Properties Of Electrochemical And Chemical Rate Constants". J. Phys. Chem. (İngilizce). 67 (4): 853-857. doi:10.1021/j100798a033.
- Marcus, R.A (1964). "Chemical and Electrochemical Electron-Transfer Theory". Annu. Rev. Phys. Chem. (İngilizce). 15 (1): 155-196. doi:10.1146/annurev.pc.15.100164.001103.
- Marcus, R.A (1965). "On the Theory of Electron-Transfer Reactions. VI. Unified Treatment for Homogeneous and Electrode Reactions" (PDF). J. Chem. Phys. (İngilizce). 43 (2): 679-701. doi:10.1063/1.1696792. 24 Kasım 2020 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 16 Kasım 2020.
- Marcus, R.A. (1985). "Electron transfers in chemistry and biology". Biochim. Biophys. Acta (İngilizce). 811 (3): 265. doi:10.1016/0304-4173(85)90014-X.










![{\displaystyle {\ce {{[Fe^{II}(CN)6]^{4-}}+{[Ir^{IV}Cl6]^{2-}}<=>{[Fe^{III}(CN)6]^{3-}}+{[Ir^{III}Cl6]^{3-}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/31656dcef696dc00f999db7bf1e70e8747989c22)
![{\displaystyle P_{if}=1-\exp \left[-{\frac {4\pi ^{2}{H_{if}^{2}}}{hv\mid (s_{i}-s_{f})\mid }}\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/81a2e37aeda14be451b6848ad207200e6055cc1e)