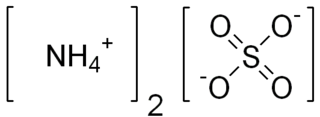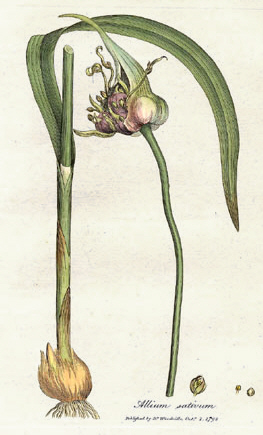
Sarımsak ya da sarmısak, Amaryllidaceae familyasına dahil olan Allium cinsinden, soğanlı bir bitki türüdür. Yakın akrabaları arasında soğan, arpacık soğanı, pırasa, Frenk soğanı ve Çin soğanı bulunur. Orta Asya'ya ve İran'ın kuzeydoğusuna özgüdür ancak birkaç bin yıllık insan tüketimi ve kullanımı geçmişi sebebiyle dünya çapında yaygın bir baharattır. Sarımsak, Antik Mısırlılar tarafından da bilinmekteydi ve hem gıda aroması hem de geleneksel ilaç olarak kullanılmıştı. Günümüzde Çin, tek başına dünyadaki sarımsak ihtiyacının yaklaşık % 80'ini karşılamaktadır.

Soy gaz veya asal gaz, standart şartlar altında her biri, diğer elementlere kıyasla daha düşük kimyasal reaktifliğe sahip, kokusuz, renksiz, tek atomlu gaz olan kimyasal element grubudur. Helyum (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe) ve radon (Rn) doğal olarak bulunan altı soy gazdır ve tamamı ametaldir. Her biri periyodik tablonun sırasıyla ilk altı periyodunda, 18. grubunda (8A) yer alır. Grupta yer alan oganesson (Og) için ise önceleri soy gaz olabileceği ihtimali üzerinde durulsa da günümüzde metalik görünümlü reaktif bir katı olduğu öngörülmektedir.

Fotosentez, bitkiler ve diğer canlılar tarafından, ışık enerjisini organizmaların yaşamsal eylemlerine enerji sağlamak için daha sonra serbest bırakılabilecek kimyasal enerjiye dönüştürmek için kullanılan bir işlemdir. Bu kimyasal enerji, karbondioksit ve sudan sentezlenen şekerler gibi karbonhidrat moleküllerinde depolanır.

Lityum, sembolü Li atom numarası 3 olan kimyasal elementtir. Periyodik tabloda 1. grupta alkali metal olarak bulunur ve yoğunluğu en düşük olan metaldir. Lityum, yüksek reaktifliğinden dolayı doğada saf hâlde bulunmaz. Yumuşak ve gümüşümsü beyaz metaldir. Havada bulunan oksijenle reaksiyona giren lityum, lityum oksit (Li2O) oluşturur. Bu oksitlenme reaksiyonunu engellemek için yağ içinde saklanır. Hava ve su tarafından hızlı bir şekilde oksitlenip kararır ve lekelenir. Lityum metali doldurulabilir pillerde (örnek olarak cep telefonu ve kamera pili) ve ağırlığa yüksek direniş göstermesi sebebiyle alaşım olarak hava taşıtlarında kullanılır. Li+ iyonunun nörolojik etkilerinden dolayı, lityumlu bileşikler farmakolojik olarak sakinleştiricilerde kullanılır.

Pastörizasyon, gıda sanayide, besin maddelerini hastalık yapıcı mikroorganizmalardan arındırmak amacıyla uygulanan ısıtma yöntemi. İlk kez 1860'larda Fransız bilim insanı Louis Pasteur tarafından geliştirilen ve onun adıyla anılan bu yöntem, mikroorganizmaların ısı yardımıyla tahrip edilmesi esasına dayanır. İçinde enzim ve bakteri bulunan besleyici özelliği olan maddenin 60 °C'den 100 °C dereceye kadar ısıl işlemle öldürme veya etkisiz hale getirilme işlemidir.

İyot, sembolü I, atom numarası 53 olan bir elementtir. Kimyasal olarak iyot halojenlerin en az reaktif olanı, astatin'den sonra en elektropozitif olanıdır. İyot başlıca tıpta, fotoğrafçılıkta ve boya imalatında kullanılır. Çoğu canlının eser miktarda iyota gereksinimi vardır.

Arsenik sembolü As atom numarası 33 olan elementtir. Arsenik, çoğu mineralde, genellikle kükürt ve metallerle bir arada veya saf bir element kristali olarak bulunur. Arsenik bir metaloiddir. Çeşitli allotroplara sahiptir, ancak yalnızca metalik bir görünüme sahip gri form endüstri için önemlidir.

Aktinyum, simgesi Ac ve atom numarası 89 olan kimyasal bir elementtir. İlk olarak 1899'da Fransız kimyager André-Louis Debierne tarafından izole edilmiştir.

Aseton, propanon ya da dimetil keton, (CH3)2CO formüllü organik kimyasal bileşiktir. Keskin, yanıcı, zehirli olmayan renksiz bir sıvıdır. Çözücü olarak çokça kullanılır. Kapalı formülü C3H6O olarak gösterilir. Su, etanol ve dietil eterle her oranda karışır. Odunun kuru kuruya damıtılmasından, asetat tuzlarının ısıtılmasından ve teknikte izopropil alkolün bakır katalizörlerinden 250 °C'de dehidrojenasyonundan elde edilir. Yağ, boya, kauçuk ve diğer maddelerin çözücüsü olarak kullanılır. Ayrıca izopropil alkol, izopren, kloroform, bromoform, iyodoform ve poli(metil metakrilat) (PMMA) gibi ürünlerin elde edilişinde öncü madde olarak kullanılır. İnsan vücudunda, normal metabolizma ürünü olarak yüksek miktarlarda üretilip atılır.
Nitrik asit, HNO3 kimyasal formülüne sahip oldukça aşındırıcı bir inorganik asittir. Kezzap olarak da bilinir. Saf hâldeki bileşik renksizdir. Ancak uzun süre bekleyen eski asitler azot oksitleri ve suya ayrışması nedeniyle sarı renge dönebilme özelliğindedirler. Piyasada bulunan nitrik asitlerin çoğu % 68'lik bir konsantrasyona sahiptir. Çözelti, %86'dan fazla HNO3 içerdiğinde, dumanlı nitrik asit olarak adlandırılır. Mevcut azot dioksit miktarına bağlı olarak, dumanlı nitrik asit ayrıca %86’nın üzerindeki konsantrasyonlarda kırmızı dumanlı nitrik asit veya %95’in üzerindeki konsantrasyonlarda beyaz dumanlı nitrik asit olarak tanımlanır.
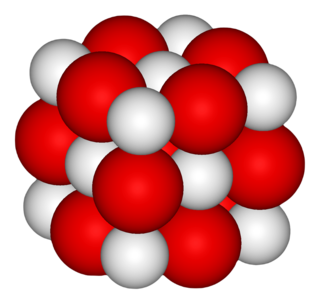
Kalsiyum oksit (CaO) ya da sönmemiş kireç geniş bir kullanım alanı bulunan bir çeşit kimyasal bileşiktir. Beyaz renkli, aşındırıcı ve alkalik bir katıdır. Sanayide kireç taşlarını yüksek sıcaklıklarda eriterek karbondioksidin uzaklaştırılmasıyla elde edilir. Suyla reaksiyona girerse oksitlenir ve kalsiyum hidroksidi oluşturur.

Sodyum nitrat formülü NaNO3 olan kimyasal bileşiktir. Güherçile'den ayırmak için Şili güherçilesi (bu ülkede büyük miktarda yığınlar halinde bulunması nedeniyle bu ad verilmiştir) adı da verilen bu beyaz renkli kristal tuz, potasyum nitrata oranla suda çok fazla çözünmektedir. Havadan nem çeker.
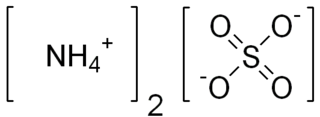
Amonyum sülfat, (NH4)2SO4 formülüne ve çok sayıda ticari kullanıma sahip bir inorganik tuzdur. Toprak gübresi olarak yaygın bir şekilde kullanılır. %21 azot ve %24 kükürt içerir.

Azot pentaoksit N2O5 formüllü kimyasal bileşik. Diazot pentaoksit olarak da bilinir. Sadece azot ve oksijen içeren azot oksit ailesinin ikili bileşiklerinden biridir. Kararsız ve potansiyel oksitleyicidir.
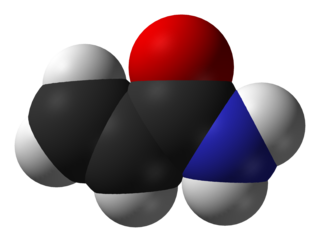
Akrilamid (ya da akrilik amid) C3H5NO kimyasal formülüne sahip kimyasal bileşik. IUPAC ismi prop-2-enamiddir. Beyaz kokusuz bir kristal katıdır, su, etanol, eter ve kloroform içinde çözünür. Akrilamid asit, baz, oksitleyici ajanlar, demir ve demir tuzlarının bulunduğu ortamda parçalanır. Termal olmayarak bozunması amonyak ve termal bozunması karbon monoksit, karbon dioksit ve azot oksitleri üretir.

Enantiyoselektif sentez ya da asimetrik sentez, bir kimyasal sentez şeklidir. IUPAC, bir veya daha fazla yeni kiralite elementinin bir substrat molekülünde oluşturulduğu ve stereoizomerik ürünleri eşit olmayan miktarlarda üreten kimyasal reaksiyon olarak tanımlanır.

İzosiyanik asit, 1830'da Liebig ve Wöhler tarafından keşfedilen HNCO formülüne sahip bir kimyasal bileşiktir. Kaynama noktası 23.5 °C olan uçucu ve zehirli renksiz bir maddedir. İzosiyanik asit, organik kimya ve biyolojide en yaygın olarak bulunan dört element olan karbon, hidrojen, azot ve oksijen içeren en basit kararlı kimyasal bileşiktir.

Trioksidan, hidrojen trioksit veya dihidrojen trioksit olarak da adlandırılan, H[O]3H (H2O3 olarak da yazılır) kimyasal formülüne sahip bir inorganik bileşiktir. Kararsız hidrojen polioksitlerdendir. Sulu çözeltilerde, trioksidan su ve tekli oksijen oluşturmak için ayrışır:

Kumarin ya da 2H-kromen-2-on, formülü C
9H
6O
2 olan, bir aromatik organik kimyasal bileşiktir. Molekül, iki bitişik hidrojen atomunun lakton benzeri bir zincirle [−(CH)=(CH)−(C=O)−O−] değiştirildiği bir benzen molekülü olarak tanımlanabilir, benzen halkası ile iki karbonu paylaşan ikinci bir altı üyeli heterohalka oluşturur. Benzopiron kimyasal sınıfına yerleştirilebilir ve bir lakton olarak kabul edilebilir.

Gıda kimyası gıdada bulunan başlıca bileşenleri, gıdayı oluşturan renkleri, tatları ve meydana gelen reaksiyonlar gibi pek çok farklı konuları ele almaktadır.