Kimya, maddenin yapısını, özelliklerini, birleşimlerini, etkileşimlerini, tepkimelerini araştıran ve uygulayan bilim dalıdır. Kimya bilmi daha kapsamlı bir ifadeyle maddelerin özellikleriyle, sınıflandırılmasıyla, atomlarla, atom teorisiyle, kimyasal bileşiklerle, kimyasal tepkimelerle, maddenin hâlleriyle, moleküller arası ve moleküler kuvvetlerle, kimyasal bağlarla, tepkime kinetiğiyle, kimyasal dengenin prensipleriyle vb konularla ilgilenir. Kimyanın en önemli dalları arasında analitik kimya, anorganik kimya, organik kimya, fizikokimya ve biyokimya sayılır.

Element, aynı cins atomlardan oluşan ve kimyasal yollarla kendinden daha basit ve farklı maddelere ayrılamayan saf maddelere verilen isimdir.
Alkali metaller periyodik tablonun birinci grubunda yer alan metallerdir. Fransiyum dışında hepsi, yumuşak yapıda ve parlak görünümdedir.
Periyodik tabloda dikey sütunlara grup denir. Aynı grupta olan elementlerin kimyasal özellikleri benzerdir. Yukarı doğru dikeyce çıktıkça özellik yoğunlaşır ve belirginleşir. Bir A grubuna ait elementin son katmanında kaç elektron varsa grup sıralaması da odur. Örneğin, berilyum (Be) atomunun son katmanında 2 elektron vardır ve bu atom 2A grubunun elementi olur.
Lantanitler, geçiş metallerinin bir alt serisini oluştururlar. 57 ile 71 atom numaraları arasındaki elementleri kapsar. 17 nadir toprak elementinin 15 tanesi lantanit grubundandır. Bu nedenle lantanitler nadir toprak elementleri olarak da isimlendirilmiştir.

Metal, yüksek elektrik ve ısı iletkenliği, kendine özgü parlaklığı olan, şekillendirmeye yatkın, katyon oluşturma eğilimi yüksek, oksijenle birleşerek çoğunlukla bazik oksitler veren elementler.

Rutenyum, element sembolü Ru ve atom numarası 44 olan kimyasal elementtir. Perdiyodik sistemin geçiş metalleri bölgesinde bulunmaktadır ve 5. periyodun 8. grubunda yer almaktadır. Gümüş renginde, sert ve pürüzlü bir metaldir. Rutenyum 1844 yılında Alman kimyacı Karl Ernst Claus tarafından Sibirya Platin madenlerinde keşfedilmiştir. Rutenyum çok nadirdir ve az miktarlarda kullanılır. Elektro sanayisinde ve katalizör olarak kullanılmaktadır.

Kurşun (Pb) atom numarası 82, atom kütlesi 207,19 olan mavi-gümüş rengi karışımı bir elementtir. 327,5 °C'ta erir ve 1740 °C'ta kaynar. Doğada, kütle numaraları 208, 206, 207 ve 204 olmak üzere 4 kararlı izotopu vardır.

Tungsten veya diğer adıyla volfram, atom numarası 74, atom ağırlığı 183,85 olan ve kimyasal simgesi W ile gösterilen, yoğunluğu 19,3 g/cm³ olan, 3482 °C'de eriyebilen kimyasal bir elementtir. Çok sert, ağır, çelik gri ya da beyaz renkte geçiş metallerinden biri olan tungsten, wolframite ve scheelite içeren madenlerde bulunur. Tungsten, sağlam fiziksel yapısı ve yüksek erime sıcaklığı olan önemli bir maddedir. Erime sıcaklığı en yüksek olan metaldir. Saf haliyle bazı elektronik uygulamalarda kullanılır, ancak çoğunlukla bileşik ya da alaşım olarak, diğer metallerin işlenmesi veya madencilik gibi uygulamalarda malzeme dayanımı gerektiren ekipmanlarda, ampullerin lamba tellerinde, X ışını cihazlarında ve uzay teknolojisi yüksek performans alaşımlarında kullanılır.

Molekül, birbirine bağlı gruplar halindeki atomların oluşturduğu kimyasal bileşiklerin en küçük temel yapısına verilen addır. Diğer bir ifadeyle bir molekül bir bileşiği oluşturan atomların eşit oranlarda bulunduğu en küçük birimdir. Moleküller yapılarında birden fazla atom içerirler. Bir molekül aynı iki atomun bağlanması sonucu ya da farklı sayılarda farklı atomların bağlanması sonucunda oluşabilirler. Bir su molekülü 3 atomdan oluşur; iki hidrojen ve bir oksijen. Bir hidrojen peroksit molekülü iki hidrojen ve 2 oksijen atomundan oluşur. Diğer taraftan bir kan proteini olan gamma globulin 1996 sayıda atomdan oluşmakla birlikte sadece 4 çeşit farklı atom içerir; hidrojen, karbon, oksijen ve nitrojen. Molekülleri oluşturan kimyasal bağlara Moleküler bağlar denir. Bunlar kovalent, iyonik ve metalik bağlardır.

Talyum, periyodik element tablosunda 3A grubunda yer alan, atom numarası 81, atom ağırlığı 204,39 olan metal elementi.

Sezyum, atom numarası 55 olan, alkali metaller grubuna ait bir kimyasal element. Element oda sıcaklığında katı olsa da 28 °C'de erimektedir. Sezyuma doğada ender rastlanır. Gümüşümsü altın renklidir ve metalik yapıdadır. Element, Robert Wilhelm Bunsen ve Gustav Kirchoff tarafından 1860 yılında mineral suyunda keşfedildi.

Lantan, La sembolü ile bilinen, atom no: 57 ve atom ağırlığı: 138.92 olan kimyasal element.

Terbiyum, atom numarası 65, atom ağırlığı 159 olan, çok ender bulunan bir element.

Atom numarası 72, atom ağırlığı 178,6 olan, az rastlanır bir element. Kısaltması Hf.

Paladyum, Pd işaretiyle bilinen, platine benzer, atom no: 46 ve atom ağırlığı: 106.42 olan kimyasal element. 1803'te William Hyde Wollaston tarafından bulunan Kıymetli metallerden sayılır. Paladyum metali gruptaki metallerin en değerlisidir. Beyaz altın elde edilmesinde kullanılır. 21.09.2020 itibarıyla fiyatı 2,337.50$ ons'dur.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.
Alaşım, bir metal elementin en az bir başka element ile birleşmesiyle oluşan homojen karışımıdır. Elde edilen malzeme yine metal karakterli malzeme olur. Alaşımlar karışıma giren metallerin özelliklerinden farklı özellikler gösterirler. En bilinen alaşımlara; tunç (bakır-kalay), pirinç (bakır-çinko), lehim (kalay-kurşun) ve cıva alaşımları olan amalgamlar örnek verilebilir. Alaşımlar, uygulamaların gerektirdiği fiziksel özelliklere sahip malzemeler üretilmesinde yaygın olarak kullanılır.
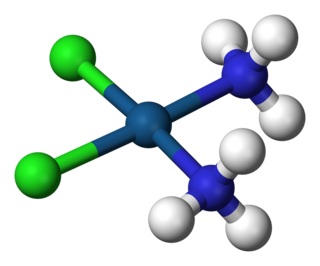
Kompleks, merkez atom olarak bir ya da birden fazla metal atomu veya iyonu ve metale bağlı ligandlardan oluşan yapıdır. Ligand, metale elektron vererek kompleks oluşturur. Metal içeren bileşiklerin birçoğu, özellikle geçiş metalleri içerenler koordinasyon bileşikleridir.

Nadir toprak elementleri ya da kısaca NTE, lantanitlerle birlikte itriyum ve skandiyum elementlerinin oluşturduğu bir grubu kapsamaktadır. Lantanitler atom numaraları 57'den 71'e kadar olan ve kimyasal olarak benzer elementlerin oluşturduğu bir gruptur. Atom numarası 39 olan itriyum ve atom numarası 21 olan skandiyum da lantanitlerle benzer kimyasal özellikleri nadir toprak elementlerinin içine dâhil edilmiştir. Yerkabuğunda diğer minerallere oranla daha fazla bulunmadıkları sanıldığından dolayı bu ismi almışlardır.
















