
Sodyum, periyodik cetvelde Na simgesi ile gösterilen ve atom numarası 11 olan element. Sodyum yumuşak ve kaygan bir metal olup alkali metaller grubuna aittir. Doğal bileşiklerin içinde bol miktarda bulunur. Yüksek oranda reaktiftir, sarı bir alevle yanar, su ile şiddetli reaksiyon verir ve havada hızla oksitlenir. Dolayısıyla, vazelin, gazyağı gibi hava ve su ile temasını kesecek bir ortamda saklanması gerekir.

Azot ya da nitrojen, simgesi N olan bir element olup atom numarası 7'dir. Renksiz, kokusuz, tatsız ve inert bir gazdır. Azot, dünya atmosferinin yaklaşık %78'ini oluşturur ve tüm canlı dokularında bulunur. Azot ayrıca, amino asit, amonyak, nitrik asit ve siyanür gibi önemli bileşikler de oluşturur.
İnorganik kimya veya anorganik kimya; organik olmayan, yani karbon-hidrojen bağı içermeyen bileşiklerin özelliklerini ve kimyasal davranışlarını inceleyen kimya dalı. Anorganik ve organik kimyayı birleştiren organometalik bileşikler, organometalik kimya adında başka bir dalı oluşturur.

Nitrat, (kim. sembol NO3-), kimyada bir azot ve üç oksijen atomundan oluşan bir nitrik asit (kim. sembol HNO3) tuzu iyonudur. Moleküler ağırlığı 62.0049'dur. Moleküler geometrisi düzlem üçgendir ve oksijen atomları arasındaki açı 120 derecedir.
Nitrik asit, HNO3 kimyasal formülüne sahip oldukça aşındırıcı bir inorganik asittir. Kezzap olarak da bilinir. Saf hâldeki bileşik renksizdir. Ancak uzun süre bekleyen eski asitler azot oksitleri ve suya ayrışması nedeniyle sarı renge dönebilme özelliğindedirler. Piyasada bulunan nitrik asitlerin çoğu % 68'lik bir konsantrasyona sahiptir. Çözelti, %86'dan fazla HNO3 içerdiğinde, dumanlı nitrik asit olarak adlandırılır. Mevcut azot dioksit miktarına bağlı olarak, dumanlı nitrik asit ayrıca %86’nın üzerindeki konsantrasyonlarda kırmızı dumanlı nitrik asit veya %95’in üzerindeki konsantrasyonlarda beyaz dumanlı nitrik asit olarak tanımlanır.

Gümüş nitrat en önemli gümüş tuzudur. Renksiz ağır kristallerden oluşur. Tıpta dağlamak maksadıyla kullanılır ve antibakteriyel özelliği vardır. Bu özelliğinden dolayı siğil tedavisinde sıkça kullanılır. Ayrıca deriyi ve organik maddeleri karartmada tercih edilir. Deriyi kararttığından cehennem taşı ismini almıştır. Suda ve alkolde kolayca çözündüğünden birçok gümüş bileşiklerinin elde edilmesinde ilkel madde olarak kullanılır. En çok kullanıldığı yerler, başta fotoğrafçılık olmak üzere mürekkepler, saç boyası yapımı ve gümüş kaplamacılığıdır.bileşenleri gümüş ve nitrik asittir. Sentezi ise örnekteki formüle göre yapılır:
- Ag + 2 HNO3 → AgNO3 + NO2 + H2O
Kalsiyum hipoklorit, Ca(ClO)2 formülüyle gösterilen bir hipoklorit tuzudur. Günlük hayatta su arıtım ve havuz temizleme sistemleri ve sıvı çamaşır suyunda kullanılmaktadır.
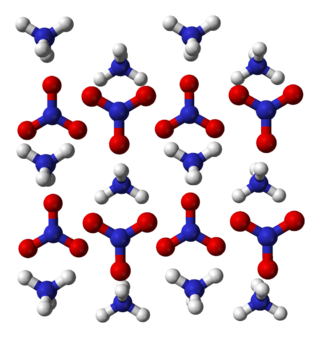
Amonyum nitrat, amonyum ve nitrat iyonlarından oluşan, NH4NO3 formülüne sahip yüksek patlayıcı bir kimyasal bileşiktir. Higroskopik özellikte ve beyaz kristal bir katı olarak hidrat oluşturmasa da suda çok çözünür. Ağırlıklı olarak, tarımda yüksek azotlu gübre olarak kullanılmaktadır. 2017 yılında küresel üretimi 21.6 milyon ton olarak tahmin edildi.

Sodyum nitrat formülü NaNO3 olan kimyasal bileşiktir. Güherçile'den ayırmak için Şili güherçilesi (bu ülkede büyük miktarda yığınlar halinde bulunması nedeniyle bu ad verilmiştir) adı da verilen bu beyaz renkli kristal tuz, potasyum nitrata oranla suda çok fazla çözünmektedir. Havadan nem çeker.

Baryum nitrat kimyasal formülü Ba(NO3)2 olan baryum ve nitrat iyonundan meydana gelmiş bir tuzdur.
Stronsiyum nitrat formülü Sr(NO3)2 olan inorganik bileşiktir. Beyaz kristallere sahip bu bileşik piroteknik bileşimlerde kırmızı renk vermek için kullanılır.

Çinko nitrat, formülü Zn(NO3)2 olan bir çinko bileşiğidir. Bu beyaz, kristal katı bileşik havadan çok nem çekerek sulanır ve genellikle hekzahidrat Zn(NO3)2•6H2O formunda bulunmaktadır. Çinko nitrat su ve alkolde çözünür.
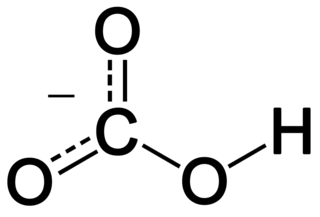
Bikarbonat, inorganik kimyada, (IUPAC-önerilen isim: hidrojen karbonat) karbonik asitin protonsuzlaştırılmasındaki bir ara yapı. HCO3− kimyasal formülene sahip moleküler iyondur.
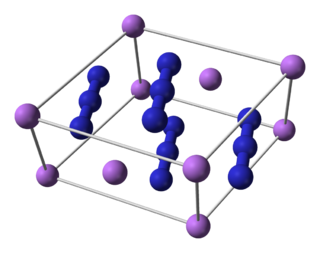
Lityum azit hidrazoik asitin lityum tuzu.Kararsız ve toksik olan bu bileşik ısıtıldığında nitrat ve lityum bileşenlerine ayrışır.

Azot pentaoksit N2O5 formüllü kimyasal bileşik. Diazot pentaoksit olarak da bilinir. Sadece azot ve oksijen içeren azot oksit ailesinin ikili bileşiklerinden biridir. Kararsız ve potansiyel oksitleyicidir.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.

Bakır (II) nitrat Cu(NO3)2(H2O)x formülüne sahip inorganik bileşikler ailesinin herhangi bir üyesini tanımlar. Hidratlar mavi katılardır. Susuz bakır nitrat mavi-yeşil kristaller oluşturur ve 150-200 °C'de vakumda süblimleşir. Yaygın hidratlar hemipentahidrat ve trihidrattır.

Magnezyum nitrat Mg(NO3)2(H2O)x formülüne sahip inorganik bileşikleri ifade eder. Formüldeki, x = 6, 2 ve 0 olabilir. Hepsi beyaz renkli katılardır. Susuz madde higroskopiktir, havada bekletildiğinde hızlı bir şekilde hekzahidrat oluşturur. Bütün tuzları hem suda hem de etanolde çok çözünür.

Mangan(II) nitrat Mn(NO3)2•(H2O)n formülüne sahip bir inorganik bileşiktir. Her formül birimi bir Mn2+ katyon ve iki NO3− anyonu ile değişen miktarlarda sudan oluşur. En yaygın olanı tetrahidrat Mn(NO3)2•4H2O dır. Fakat, susuz bileşiğin yanı sıra mono ve hekzahidratlar da bilinmektedir. Bu bileşiklerin bazıları, mangan oksitleri için faydalı öncül maddelerdir.
Gümüş asetilür, formülü Ag2C2 olan bir metalik asetilür, inorganik kimyevi bileşiktir. Gümüş karbür olarak da bilinir. Nileşik, zayıf bir asit olan asetilenin tuzu olarak kabul edilir. Tuzun anyonu birbirine üçlü bağla bağlanmış iki karbon atomundan oluşur.

















