
Lityum, sembolü Li atom numarası 3 olan kimyasal elementtir. Periyodik tabloda 1. grupta alkali metal olarak bulunur ve yoğunluğu en düşük olan metaldir. Lityum, yüksek reaktifliğinden dolayı doğada saf hâlde bulunmaz. Yumuşak ve gümüşümsü beyaz metaldir. Havada bulunan oksijenle reaksiyona giren lityum, lityum oksit (Li2O) oluşturur. Bu oksitlenme reaksiyonunu engellemek için yağ içinde saklanır. Hava ve su tarafından hızlı bir şekilde oksitlenip kararır ve lekelenir. Lityum metali doldurulabilir pillerde (örnek olarak cep telefonu ve kamera pili) ve ağırlığa yüksek direniş göstermesi sebebiyle alaşım olarak hava taşıtlarında kullanılır. Li+ iyonunun nörolojik etkilerinden dolayı, lityumlu bileşikler farmakolojik olarak sakinleştiricilerde kullanılır.

Brom (Br), Antoine Balard tarafından 1826 yılında keşfedilen halojen ametal. Yunanca dışkı gibi koku anlamındaki bromosdan gelmiştir.
İnorganik kimya veya anorganik kimya; organik olmayan, yani karbon-hidrojen bağı içermeyen bileşiklerin özelliklerini ve kimyasal davranışlarını inceleyen kimya dalı. Anorganik ve organik kimyayı birleştiren organometalik bileşikler, organometalik kimya adında başka bir dalı oluşturur.

Bir lityum-iyon veya Li-iyon pil, enerji depolamak için lityum iyonlarının tersine çevrilebilir indirgemesini kullanan şarj edilebilir pil türüdür. Geleneksel lityum iyon pilinin anodu genelde karbon'dan yapılan grafit'tir. Katot genellikle metal oksit'tir. Elektrolit genelde bir organik çözücü içindeki lityum tuz'udur.

Lityum hipoklorit (LiClO) saydam, renksiz ve berrak bir tür tuz çeşididir. Bu madde çoğu yerde havuz sterilizasyonu için ve kimi maddeler için ayrıştırıcı madde olarak kullanılmaktadır.
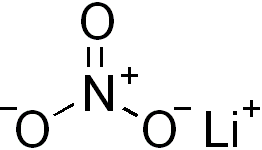
Lityum nitrat LiNO3 formüllü inorganik bileşik. Nitrik asitin lityum tuzudur. Lityum karbonat veya lityum hidroksitin nitrik asit ile reaksiyonundan elde edilir.

Sodyum bromür, NaBr formülüne sahip inorganik bir bileşiktir. Yüksek erime noktasına sahip beyaz kristal yapısıyla sofra tuzuna benzemektedir. Genellikle bromür iyonu kaynağı olarak çeşitli alanlarda kullanılmaktadır.

Lityum polimer pil veya daha doğrusu lityum-iyon polimer pil, sıvı elektrolit yerine jel polimer elektrolit kullanan, lityum-iyon teknolojisine sahip şarj edilebilir bir pildir. Bu piller, diğer lityum pil türlerinden daha yüksek özgül enerji sağlar ve mobil cihazlar, radyo kontrollü uçaklar ve bazı elektrikli araçlar gibi ağırlığın kritik bir özellik olduğu uygulamalarda kullanılır.

Sodyum bromat kimyasal formülü NaBrO3 olan inorganik bir bileşiktir. Bromik asitin sodyum tuzu olarak geçer. Güçlü bir oksidandır.

Lityum florür LiF formülüne sahip inorganik bileşik. Renksiz bir katıdır, kristal boyutu küçüldükçe beyaz renge geçiş görülür. Kokusuz olmasına rağmen tuzlu-acı bir tada sahiptir. Sodyum klorüre benzer yapıdadır fakat suda daha az çözünür. Esas olarak erimiş tuz yapısında kullanılır. LiF'nin elementlerinden oluşumu ikinci en yüksek reaktant kütlesi başına enerjiyi verir, birinci BeO'dur.

Çinko bromür (ZnBr2), ZnBr2 kimyasal formülüne sahip bir inorganik bileşiktir. Renksiz bir tuzdur ve çinko klorür (ZnCl2) ile pek çok ortak özellik taşır; organik çözücüler içinde çözünürler ve asiditesi yüksek çözeltiler oluşturmak üzere, su içinde yüksek çözünürlüğe sahiptirler. Higroskopiktir ve 2H2O·ZnBr2 dihidratını oluşturur.

Hidrojen bromür, HBr formülüne sahip iki atomlu moleküldür. Renksiz bir bileşik ve bir hidrojen halojenürdür. Hidrobromik asit, su içinde bir HBr çözeltisidir. Hem HBr'nin susuz hem de sulu çözeltileri, bromür bileşiklerinin hazırlanmasında ortak reaktiflerdir.
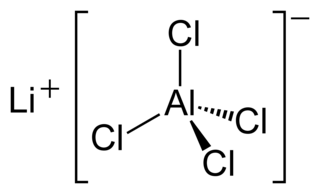
Lityum tetrakloroalüminat (LAC, lityum alüminyum klorür), LiAlCl4 formülüne sahip inorganik bir bileşiktir.

Hipobromöz asit, kimyasal formülü HOBr olan çok zayıf ve kararsız bir asittir. Esas olarak sulu çözelti içinde üretilir ve işlenir. Dezenfektan olarak hem biyolojik hem de ticari olarak üretilir. Hipobromit tuzları nadiren katı madde olarak izole edilir.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.

Akira Yoshino, Nobel Kimya Ödüllü Japon kimyagerdir. Asahi Kasei şirketinin bir çalışanı ve Nagoya'daki Meijo Üniversitesi'nde profesördür. Dünyada ilk defa olarak cep telefonları ve dizüstü bilgisayarlarda kullanılacak olan güvenli, üretilebilir lityum iyon pili icat etti. Yoshino, 2019 yılında M. Stanley Whittingham ve John B.Goodenough ile Nobel Kimya Ödülü'ne layık görüldü.

Lityum metoksit, LiCH3O formülüne sahip bir bileşiktir. Metanolün lityum tuzudur. Daha ağır alkollerden türetilen lityum alkoksitlerin aksine, lityum metoksit bağlanmasında büyük ölçüde iyoniktir. THF gibi yaygın polar aprotik çözücüler içindeki çözünürlüğü düşüktür; bununla birlikte, metanol içinde çözünür ve ticari olarak %10'luk bir çözelti halinde bulunur.
Bromoetan olarak da bilinen etil bromür, haloalkanlar grubuna ait bir kimyasal bileşiktir. Kimyacılar tarafından EtBr olarak kısaltılır. Bu uçucu bileşik, eter benzeri bir kokuya sahiptir.
Lityum-sülfür pil bir tür şarj edilebilir pildir. Yüksek özgül enerjisi ile dikkat çekmektedir. Lityumun düşük atom ağırlığı ve kükürdün orta derecede atom ağırlığı, Li-S pillerin nispeten hafif olduğu anlamına gelir. Ağustos 2008'de Zephyr 6 tarafından en uzun ve en yüksek irtifa insansız güneş enerjisiyle çalışan uçak uçuşunda kullanıldılar.
Hidrobromik asit, hidrojen bromürün sulu çözeltisidir. Diatomik molekül hidrojen bromürün (HBr) suda çözünmesiyle oluşan güçlü bir asittir.

















