
Flor, atom numarası 9, atom ağırlığı 19, yoğunluğu 1,265 olan, kokusu ozonu andıran, kahverengimsi sarı renkte, halojenler grubunun ilk elementidir. 1529 yılında Georgius Agricola, kalsiyum florür bileşiğini tanımlamıştır. İlk defa 1886 yılında Henri Moissan tarafından izole edilmiştir.

Soy gaz veya asal gaz, standart şartlar altında her biri, diğer elementlere kıyasla daha düşük kimyasal reaktifliğe sahip, kokusuz, renksiz, tek atomlu gaz olan kimyasal element grubudur. Helyum (He), neon (Ne), argon (Ar), kripton (Kr), ksenon (Xe) ve radon (Rn) doğal olarak bulunan altı soy gazdır ve tamamı ametaldir. Her biri periyodik tablonun sırasıyla ilk altı periyodunda, 18. grubunda (8A) yer alır. Grupta yer alan oganesson (Og) için ise önceleri soy gaz olabileceği ihtimali üzerinde durulsa da günümüzde metalik görünümlü reaktif bir katı olduğu öngörülmektedir.

İyot, sembolü I, atom numarası 53 olan bir elementtir. Kimyasal olarak iyot halojenlerin en az reaktif olanı, astatin'den sonra en elektropozitif olanıdır. İyot başlıca tıpta, fotoğrafçılıkta ve boya imalatında kullanılır. Çoğu canlının eser miktarda iyota gereksinimi vardır.

Neon (Ne), periyodik tablonun 8-A grubunda yer alan soy gazdır. Atom numarası 10'dur.

Kripton, periyodik tablonun 8-A grubunda yer alan, atom numarası 36, simgesi ise Kr olan ve soy gaz özellikleri gösteren kimyasal elementtir. Tek atomlu, renksiz, tatsız ve kokusuz bir gazdır. Hacim olarak, havada milyonda bir oranında bulunur. Soygazlar arasında ksenondan sonra en kolay sıvılaşandır (-152,9 °C). Kimyasal etkinliği yoktur. Isı iletkenliği kötüdür. Bu yüzden ksenonla birlikte kimi akkor lambaların içine, filamanın yüksek ısıya gelip daha bol ışık vermesi amacıyla kullanılır. Kriptondan, deşarj tüplerinde, ışık kaynağı olarak yararlanılır. Turuncu ışınım veren izotoplarından biri, Ekim 1983'e dek temel uzunluk birimi olan metrenin tanımlanmasında kullanıldı.

Terbiyum, atom numarası 65, atom ağırlığı 159 olan, çok ender bulunan bir element.
Ksenon, Xe sembolü ile gösterilen 54 atom numaralı kimyasal elementtir. Renksiz, ağır, kokusuz bir soy gaz olan ksenon Dünya atmosferinde eser miktarda bulunur. Genellikle reaktif olmayan element, sentezlenen ilk soy gaz bileşiği olan ksenon heksafloroplatinatın oluşumu gibi birkaç kimyasal reaksiyona maruz kalabilir.

Ksenon tetraflorür (XeF4) bir ksenon atomu, dört flor atomundan oluşan bileşik.

Kripton diflorür, KrF2 kripton ve florun oluşturduğu kimyasal bileşiktir. Keşfedilen ilk kripton bileşiği olan kripton diflorür uçucu renksiz bir katıdır. KrF2'nin yapısı lineerdir ve Kr-F mesafesi 188,9 pm'dir. Güçlü Lewis asitleri ile reaksiyona girerek KrF+ ve Kr2F3+ katyon tuzlarını oluşturur. KrF2 en kolay ve en fazla üretilebilen kripton bileşiğidir. Oldukça güçlü bir oksitleyici ajan olan kripton diflorür, ksenonu ksenon hekzaflorüre veya iyotu iyot pentaflorüre dönüştürebilme kabiliyetine sahiptir. Bu oksidant özelliği ile florürleri ve altını oksitlemede kullanılır.

Soy gaz bileşiği, içeriğinde en az bir soy gaz olan bileşiklerdir. 20. yüzyılın ortalarına kadar genel kanı soy gazların kimyasal tepkimelere giremeyecekleri, dolayısıyla bileşik oluşturamayacakları yönündeydi.

Ksenik asit, suyun içinde ksenon trioksitin dağılması ile oluşan bir soy gaz bileşiğidir. Kimyasal yapısı H2XeO4 olan ksenik asit, çok güçlü bir oksitleyici maddedir. Büyük miktarda ksenon, oksijen ve ozon gibi gazlar ürettiği için ayrışımı tehlikelidir.
Ksenon hekzafloroplatinat (Xe+[PtF6]−), Britanya Kolumbiyası Üniversitesi'nde Neil Bartlett'in gerçekleştirdiği, soy gazların kimyasal tepkimesini ispat eden bir deneyde; platin hekzaflorür ve ksenon tepkimesiyle ortaya çıkan ürünün adı.

Ksenon diflorür, kimyasal formülü XeF2 olan güçlü bir florürleyici maddedir. En stabil ksenon bileşiklerinden biridir. Kovalent inorganik florürlerin birçoğu gibi neme duyarlıdır. Işık veya su buharı ile temas ettiğinde ayrışır. Ksenon diflorür, yoğun beyaz kristalli bir katıdır. Mide bulandırıcı kokuya ve düşük buhar basıncına sahiptir.
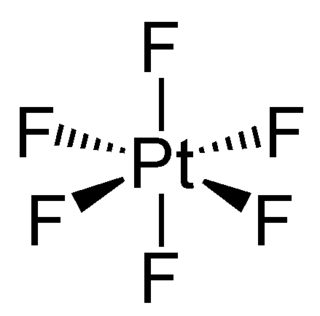
Platin hekzaflorür PtF6 formülüne sahip bileşiktir. Koyu kırmızı kristal kırmızı renkteki gaz formuna dönüşür. Bileşik, platinin +6 yükseltgenme seviyesi aldığı tek örnektir. D orbitallerindeki 4 elektron sayesinde bileşik paramanyetiktir. Bileşik kaliteli bir oksidan ve floritasyon maddesidir. Pt-F bağ uzunluğu 185 pikometredir.

Ksenon ark lambası yüksek yoğunluğa sahip iyonlaşmış ksenon gazına elektriksel potansiyel uygulayarak ışık üreten bir gaz deşarj lambasıdır. Gün ışığına benzeyen parlak beyaz bir renk üreten ksenon ark lambası sinemalardaki gösterim aygıtlarında sıkça kullanılmaktadır.

Perksenatlar, ksenonun oluşturduğu XeO4-6 anyonunu içeren tuzlardır. Bu tuzlar, Raman saçılmasıyla belirlenen sekiz yüzlü moleküler geometri yapısına sahip olup oksijen-ksenon-oksijen bağ açıları 87° ile 93° arasında değişkenlik gösterir. Ksenon ile oksijen arasındaki bağın uzunluğu ise X ışını kristalografisi tarafından 1,875 Å olarak belirlenir.

Ksenon tetroksit, kimyasal formülü XeO4 olan, ksenon ile oksijen elementlerinin reaksiyonuyla meydana gelen soy gaz bileşiğidir. Ksenon tetroksit, -35,9 °C sıcaklıkta kristal yapıda ve sarı renkli bir katı hâlde olup, daha sıcak ortamlarda ksenon ve oksijen (O2) elementlerine çözünmeye yatkındır.

Ksenon dioksit veya diğer adıyla ksenon(IV) oksit, kimyasal formülü XeO2 olan, ksenon ile oksijen elementlerinin reaksiyonuyla meydana gelen soy gaz bileşiğidir. İlk olarak 2011'de, ksenon tetraflorürün (2,00 mol/L H2SO4 ile) hidrolize uğratılmasıyla sentezlenmiştir.
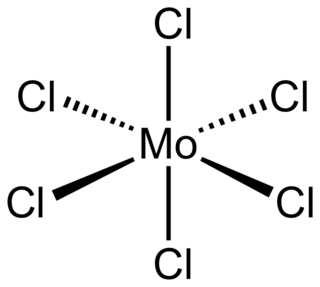
Molibden(VI) klorür, MoCl6 formülüne sahip bir inorganik bileşiktir. Siyah ve diyamanyetik olan bir katıdır. Moleküllerin kristal yapısı tungsten (VI) klorür gibi oktahedraldir.
Unbiseptiyum, 127 atom numarasına sahip, henüz üretilmemiş varsayımsal bir kimyasal element. Süperaktinitler sınıfına dahil olacak elementin, 127 elektron ve proton ile 209 nötrona sahip olması ve 8. periyotta yer alması beklenmektedir. Unbiseptiumun atom kütlesinin ise 336 u olacağı hesaplanmıştır.

















