Panzehir, bir zehirin etkisini önleyen veya yok eden madde. Panzehirler ağız yoluyla zehirlenmelerde emilimi azaltmak amacıyla kullanılanlar ve kan dolaşımına çeşitli yollarla karışmış olan zehire karşı kullanılanlar olmak üzere iki büyük grupta toplanırlar.
Elektrokimya, kimya biliminin bir alt dalı olup elektronik bir iletken ile iyonik bir iletken (elektrolit) arayüzeyinde gerçekleşen reaksiyonları inceler. Elektrokimyada amaç kimyasal enerji ve elektrik enerjisi arasındaki değişimi incelemektir.

Alışıla gelmiş elektrik üretim sistemleri yakıtın içindeki enerjiyi elektriğe dönüştürmek için ilk olarak yanma reaksiyonunu kullanır. Yanma reaksiyonunun verimli bir şekilde gerçekleşmesi için yakıtın ve oksitleyicinin (oksijen) tam olarak karışması gerekir. Bundan sonra elektrik enerjisi üretilene kadar bir dizi ara işlem gereklidir. Her ara işlem enerji kaybına yol açar dolayısıyla verimi düşürür.
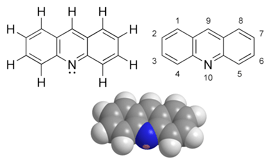
Akridin, C13H9N, heterosiklik bir organik bileşiktir. Akridin terimi ayrıca C13N üçlü halkasını içeren bileşiklere değinmek için kullanılır.
Alüminyum-hava pilleri, havadaki oksijenin alüminyum ile reaksiyonundan elektrik üretir. Tüm piller arasında en yüksek enerji yoğunluklarından birine sahiptirler, ancak yüksek anot maliyeti ve geleneksel elektrolitler kullanılırken çıkan yan ürün sorunları nedeniyle yaygın olarak kullanılmazlar. Bu durum, kullanımlarını esas olarak askeri uygulamalarla sınırlamıştır. Bununla birlikte, alüminyum pillere sahip bir elektrikli araç, bir lityum iyon pilin menzilinin sekiz katına kadar potansiyele sahiptir.

Yaklaşık 19.yüzyılın sonlarında, elektrikli jeneratörlerin ve elektrikli güç kaynaklarının geliştirilmesinden önce ana elektrik kaynağını piller sağlamaktaydı. Batarya teknolojisinde art arda gelen yenilikler, ilk bilimsel çalışmalardan tutun da, telgraf ve telefonların yükselişini ve nihayet portatif bilgisayarları, cep telefonların, elektrikli arabaları ve diğer birçok elektrikli aletler de dahil elektrik alanındaki başlıca gelişmeleri kolaylaştırmıştır.

Düğme pil veya saat pili, küçük çaplı tek hücreli bir pil olup çapı 5mm ila 25mm, giysinin üzerinde bir düğme gibi 1mm ila 6mm yüksekliğinde bir çöp silindiri şeklindedir. Bir metal, hücrenin alt gövdesini ve pozitif terminalini oluşturabilir. Yalıtımlı üst kapak negatif terminaldir.

Cıva pil şarj edilemeyen bir elektrokimyasal pil, birincil bir pildir. Cıva pilleri, alkalin bir elektrolit içinde merkürik oksit ile çinko elektrotları arasında bir reaksiyon kullanır. Deşarj sırasındaki voltaj 1.35 Volt'ta pratik olarak sabit kalır ve kapasitesi benzer şekilde boyutlandırılmış çinko karbon pilinden daha fazladır. Cıva pilleri saatler, işitme cihazları, kameralar ve hesap makineleri için düğme pilleri biçiminde ve diğer uygulamalar için daha büyük formlarda kullanıldı.
Alkalin pil, çinko ve manganez dioksit (Zn / MnO2) arasındaki reaksiyona bağlı olarak birincil pil türüdür.

Çinko-karbon pil uygun bir elektrolit aracılı çinko ve manganez dioksit arasındaki elektrokimyasal tepkimelerden bir çinko metal elektrodu ile bir karbon çubuk arasında 1,5 volt potansiyel sağlayan kuru bir pildir. Genellikle uygun bir şekilde negatif potansiyele sahip anot görevi gören bir çinko kutu içinde, buna karşın atıl karbon çubuğu pozitif katotta paketlenir. Genel amaçlı piller muhtemelen bazı çinko klorür çözeltisi ile karıştırılmış amonyum klorür sulu bir macunu elektrolit olarak kullanılabilir. Ağır iş tiplerinde öncelikle çinko klorürden oluşan bir macun kullanılır.

Nikel-kadmiyum pil elektrot olarak nikel oksit hidroksit ve metalik kadmiyum kullanan bir şarj edilebilir pil türüdür. NiCd kısaltması, nikel (Ni) ve kadmiyum (Cd) kimyasal sembollerinden türemiştir: NiCad kısaltması, SAFT Corporation'ın tescilli bir ticari markasıdır, ancak bu marka adı tüm Ni-Cd pillerini tanımlamak için yaygın olarak kullanılmaktadır.

Bunsen hücresi nitrik veya kromik asitte bir karbon katodundan gözenekli bir pota ayrılmış seyreltik sülfürik asitte bir çinko anottan oluşan bir çinko-karbon birincil hücredir.

Grove hücresi Galler'in fizik bilimcisi William Robert Grove'dan alınıp, seyreltik sülfürik asitte bir çinko anot ve konsantre nitrik asitte platin katottan oluşan ve gözenekli bir seramik kap ile ayrılmış olan bir elektrikli ilk hücredir.

Clark hücresi 1873'te İngiliz mühendis Josiah Latimer Clark tarafından icat edilen, oldukça dengeli bir voltaj üreten bir ıslak-kimyasal hücre. 1893 yılında Clark hücresinin 15 °C'deki üretimi, Uluslararası Elektrik Kongresi tarafından 1.434 volt olarak tanımlandı ve bu tanım Amerika Birleşik Devletleri'nde 1894 yılında kanun haline geldi. Bu tanım daha sonra Weston hücresine dayanan bir yöntemle değiştirildi.

Edison–Lalande pili Thomas Edison tarafından Felix Lalande ve Georges Chaperon tarafından daha önceki bir tasarımda geliştirilen bir çeşit alkalin pili idi. Bir potasyum hidroksit solüsyonunda bakır oksit ve çinkodan oluşan tabaklardan oluşuyordu. Hücre voltajı düşük idi, ancak iç direnç de düşük olduğundan bu hücreler büyük akımlar verebiliyordu.

Gümüş oksit pil ağırlık oranı açısından çok yüksek bir enerjiye sahip olan bir primer hücredir. Düğme hücreler olarak küçük boyutlarda ya da gümüş oksit kimyasının üstün performansının maliyet unsurlarından daha fazla olduğu geniş özel tasarımlı pillerde mevcuttur. Bu daha büyük hücreler çoğunlukla askeri uygulamalar, örneğin MK-37 Torpido ya da alfa sınıfı denizaltılarda bulunur.

Kuru pil taşınabilir elektrikli cihazlar için yaygın olarak kullanılan bir pil türüdür. 1886'da Alman bilim insanı Carl Gassner tarafından geliştirildi.

Sodyum bikromat Na2Cr2O7 formülüne sahip bir inorganik bileşiktir. Ancak, genellikle tuz dihidrat Na2Cr2O7•2H2O olarak kullanılır. Neredeyse tüm krom cevheri, sodyum bikromata dönüştürülerek işlenir ve neredeyse krom bazlı bütün bileşikler ve maddeler bu tuzdan hazırlanır. Reaktivite ve görünüm açısından, sodyum bikromat ve potasyum bikromat çok benzerdir. Bununla birlikte sodyum tuzu, suda potasyum tuzundan yaklaşık yirmi kat daha fazla çözünür(0 °C’de 49 g/L) ve eşdeğer ağırlığı da daha düşüktür ki bu da genellikle istenen bir durumdur.
Kromik asit terimi genellikle, katı krom trioksit de dahil olmak üzere çeşitli bileşikler içerebilen bir dikromata konsantre sülfürik asit eklenerek yapılan bir karışım için kullanılır. Bu tür kromik asit, cam için bir temizleme karışımı olarak kullanılabilir. Kromik asit ayrıca trioksitin anhidrit olduğu H2CrO4 moleküler türlerine de atıfta bulunabilir. Kromik asit, +6 (veya VI) oksidasyon durumunda krom içerir. Güçlü ve aşındırıcı bir oksitleyici ajandır.
Simya çalışmaları sayesinde daha sonra belirli kimyasal bileşikler veya bileşik karışımları olarak sınıflandırılan birçok kimyasal madde üretilmiştir.














