Karbon, doğada yaygın bulunan ametal kimyasal elementtir. Evrende bolluk bakımından altıncı sırada yer alan karbon, kızgın yıldızlarda hidrojenin termonükleer yanmasında temel rol oynar. Dünyada hem doğal halde, hem de başka elementlerle bileşik halinde bulunan karbon, ağırlık olarak Dünya'nın yerkabuğunun yaklaşık %0,2'sini oluşturur. En arı (katışıksız) biçimleri elmas ve grafittir; daha düşük arılık derecelerinde maden kömürünün, kok kömürünün ve odun kömürünün bileşeni olarak bulunur. Atmosferin yaklaşık % 0,05'ini oluşturan ve bütün doğal sularda erimiş olarak bulunan karbon dioksit, kireç taşı ve mermer gibi karbonat mineralleri, kömürün, petrolün ve doğalgazın başlıca yapıtaşları olan hidrokarbonlar, en bol bulunan bileşikleridir.

Bir fizik terimi olarak maddenin hâli, maddenin aldığı farklı fazlardır. Günlük hayatta maddenin dört farklı hâl aldığı görülür. Bunlar; katı, sıvı, gaz ve plazmadır. Maddenin başka hâlleri de bilinir. Örneğin; Bose-Einstein yoğunlaşması ve nötron-dejeneje maddesi. Fakat bu hâller olağanüstü durumlarda gerçekleşir, çok soğuk ya da çok yoğun maddelerde. Maddenin diğer hâllerininde, örneğin quark-gluon plazmalar, mümkün olduğuna inanılır fakat şu an sadece teorik olarak bilinir. Tarihsel olarak, maddenin özelliklerindeki niteleyici farklılıklara dayanarak ayrım yapılır. Katı hâldeki madde bileşen parçaları ile bir arada tutulur ve böylece sabit hacim ve şeklini korur. Sıvı hâldeki madde hacmini korur fakat bulunduğu kabın şeklini alır. Bu parçalar bir arada tutulur ama hareketleri serbesttir. Gaz hâlindeki madde ise hem hacim olarak hem de şekil olarak bulunduğu kaba ayak uydurur.Bu parçalar ne beraber ne de sabit bir yerde tutulur. Maddenin plazma hâli ise, nötr atomlarda dahil, hacim ve şekil olarak tutarsızdır. Serbestçe ilerleyen önemli sayıda iyon ve elektron içerirler. Plazma, evrende maddenin en yaygın şekilde görülen hâlidir.

Kristal, billur ya da kesme cam, kimyadaki katı haldeki bir elementin veya bileşiğin, molekül, atom veya iyon yığınlarının (paketinin) kesin geometrik bir yapı göstermesidir.

Katı, maddenin atomları arasındaki boşluğun en az olduğu halidir. "Katı" olarak adlandırılan bu haldeki maddelerin kütlesi, hacmi ve şekli belirlidir. Bir dış etkiye maruz kalmadıkça değişmez. Sıvıların aksine katılar akışkan değildir. Fiziksel yollarla, diğer üç hal olan sıvı, gaz ve plazmaya dönüştürülebilirler. Altın demir gibi madenler katı maddelere örnektir. Ayrıca katı maddeler atomlarının en yavaş hareket edebildiği haldir. Doğa'da amorf veya kristal yapıda bulunurlar. Amorf katılar maddenin taneciklerinin düzensiz olma durumudur. Kristal katılar ise de maddenin taneciklerinin düzenli olma durumudur. Kristal katılar da aralarında 4'e ayrılır.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.
Yoğun madde fiziği, maddenin yoğun hallerinin fiziksel özellikleriyle ilgilenen bir fizik dalıdır. Yoğun madde fizikçileri bu hallerin davranışını fizik kurallarını kullanarak anlamaya çalışır. Bunlar özellikle kuantum mekaniği kuralları, elektromanyetizma ve istatistiksel mekaniği içerir. En bilinen yoğun fazlar katı ve sıvılardır, harici yoğun fazlar ise düşük sıcaklıktaki bazı materyaller tarafından gösterilen üstünileten faz, atom kafeslerindeki dönüşlerin ferromanyetik ve antiferromanyetik fazları ve soğuk atom sistemlerinde bulunan Bose-Einstein yoğunlaşması. Araştırma için uygun sistemlerin ve fenomenlerin çeşitliliği yoğun madde fiziğini modern fiziğinin en aktif alanı yapıyor. Her 3 Amerikan fizikçiden biri kendini yoğun madde fizikçisi olarak tanımlıyor ve Yoğun Madde Fiziği Bölümü Amerikan Fizik Topluluğu’ndaki en geniş bölümdür. Bu alan kimya, malzeme bilimi ve nano teknoloji ile örtüşür ve atom fiziği ve biyofizikle de yakından ilgilidir. Teorik yoğun madde fiziği teorik parçacık ve nükleer fizikle önemli kavramlar paylaşır.
Çok düşük basınçlarda gaz içeren vakum çemberinde, iki elektrot arasına dc voltajı uygulanırsa, aralarında küçük voltajda bir akım geçer ve çember üzerinde düzgün bir potansiyel oluşur. Voltaj arttıkça ışıldama deşarjı oluşur. Katot akım yoğunluğu, katot üzerinde sabit kalır ve katot bölgesi, saçılan malzemenin uyarılma spektrumundan dolayı katot malzemesinin karakteristiğini gösteren renkte hafif bir ışıldamaya sahip olur. Bu renk yüzeyin saçılarak temizlenmesiyle ortaya çıkan değişim ile gözlenebilir. Daha yüksek basınçlarda, katot bölgesinin tüm katodu kapattığı görülür. Bu normal bir ışıldama bölgesidir ve iyon kaplama, saçtırmanın yapıldığı bölgedir. 1000 dc voltajda kendi kendine devam eden dc diyot gaz deşarjını elde etmek için 10 µm Argon basıncı gerekir.
Değerlik kabuğu elektron çifti itmesi kuralları moleküllerin şekillerini tahmin etmede kullanılır ve değerlik elektron çiftlerinin birbirlerini elektrostatik kuvvetle itmesi temeline dayanır. Teorinin yaratıcısı olan bilim adamlarına atfen Gillespie–Nyholm teorisi olarak da adlandırılır. "VSEPR" kısaltması kimi zaman "vespır" olarak da telaffuz edilebilir.
Teoriye göre atomları çevreleyen değerlik elektron çiftleri birbirlerini iterek aralarındaki itme kuvvetini en aza indirirler ve böylece moleküle şeklini verirler. Merkez atoma bağlı atomların sayısı ile bağ yapmamış elektron çiftlerinin sayısının toplamı sterik numarayı verir.

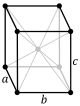
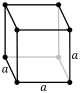
Kristalografi olarak, kübik kristal sistemi, birim hücresi bir küp biçiminde olan kristal sistemidir. Bu kristal ve mineraller bulunan en yaygın ve basit şekillerden biridir. Bu kristallerin üç ana çeşidi vardır:
- Basit Kübik Kafes (cP)
- Hacim Merkezli Kübik Kafes,
- Yüzey Merkezli Kübik Kafes

X ışını kristalografisi bir kristalin atomik ve moleküler yapısını incelemek için kullanılan ve kristalleşmiş atomların bir X-ışını demetindeki ışınların kristale özel çeşitli yönlerde kırınımı olayına dayanan, bir yöntemdir. Kırınıma uğrayan bu demetlerin açılarını ve genliklerini ölçerek bir kristalografi uzmanı kristaldeki elektronların yoğunluğunun üç boyutlu bir görüntüsünü elde edebilir. Bu elektron yoğunluğundan kristaldeki atomların kimyasal bağları, kristal yapıdaki düzensizlikler ve bazı başka bilgilerle birlikte ortalama konumları tespit edilebilir.

Kristal yapıların atom veya molekül dizilimlerinde görülen çeşitli kusurlar vardır. Bu kusurlar noktasal, çizgisel, düzlemsel ve hacimsel olmak üzere dört ana başlığa ayrılmaktadır. Bu kusurların biçimi, boyutu, miktarı ve yeri maddenin özelliklerini direkt olarak etkilemektedir.

Katı hal fiziğinde, bir katının elektron kuşak yapısı ; katıdaki bir elektronun sahip olabileceği enerji aralıkları ya da sahip olamayacağı enerji aralıkları olarak tanımlanır. Enerji bant teorisi bu bant ve bant boşluklarını atom veya moleküllerin büyük periyodik kafeslerindeki bir elektron için, izinli kuantum mekaniksel dalga fonksiyonlarını inceleyerek çıkarır. Bant teorisi katıların birçok fiziksel özelliklerini; örneğin elektriksel direnç ve optik soğurum gibi, açıklamak için başarılı bir biçimde kullanılmaktadır ve katı hal cihazları anlamanın temelini oluşturmaktadır.

Kimyada üçgen piramit, apekste bir atomun ve dört yüzlüyü andıran üçgen temelin köşelerinde üç atomun bulunduğu moleküler geometridir (dörtyüzlü moleküler geometri ile karıştırılmamalıdır). Köşelerdeki üç atomun hepsi aynı olduğunda, molekül C3v nokta grubuna aittir. Üçgen piramit geometrisi olan bazı moleküller ve iyonlar; azot grubu hidritler (XH3), ksenon trioksit (XeO3), klorat iyonu ClO3- ve sülfit iyonu SO3−2. Organik kimyada, üçgen piramit geometriye sahip moleküller bazen sp3 hibridize olarak açıklanmaktadır. AXE yöntemi için Vsepr teori sınıflandırması AX3E1'dir.
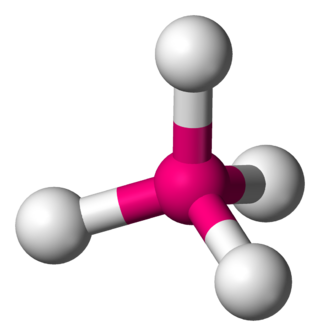
Dörtyüzlü veya tetrahedral molekül geometrisi, merkezi atomun, dört yüzlünün ortasında, dört köşede ise sübstitüentlerin yer aldığı molekül geometrisidir. Bağ açıları, dört sübstitüent aynı olduğunda (örn. metan CH4 ya da daha ağır analogları) cos−1 (-⅓) = 109,4712206 ...° ≈ 109.5° olur. Metan veya diğer simetrik yüzlü moleküller Td nokta grubuna aittir, ama dörtyüzlü moleküller genellikle düşük simetriye sahiptir. Tetrahedral moleküller kiral olabilir.

Yapı, maddi bir nesne veya sistemdeki birbiriyle ilişkili unsurların düzenlenmesi ve organizasyonu veya bu şekilde organize edilmiş nesne veya sistemdir. Maddi yapılar, binalar ve makineler gibi insan yapımı nesneleri ve biyolojik organizmalar, mineraller ve kimyasallar gibi doğal nesneleri içerir. Soyut yapılar bilgisayar bilimlerindeki veri yapılarını ve müzik formunu içerir. Yapı türleri arasında bir hiyerarşi, çoktan çoğa bağlantılar içeren bir bağlantı veya uzayda komşu olan bileşenler arasındaki bağlantıları içeren bir kafes bulunur.

Kimyasal yapının belirlemesi, bir kimyagerin hedef molekülün moleküler geometrisini ve -uygun ve gerekli olduğunda- elektronik yapısını belirlemesini içerir. Moleküler geometri, bir moleküldeki atomların uzamsal düzenini ve atomları bir arada tutan kimyasal bağları ifade eder ve yapısal formüller ile moleküler modeller kullanılarak temsil edilebilir; eksiksiz elektronik yapı açıklamaları, bir molekülün moleküler orbitallerinin konumunun belirlenmesini içerir. Yapı belirleme, çok basit moleküllerden çok karmaşık olanlara kadar bir dizi hedefe uygulanabilir.

Kimyada, oktahedral moleküler geometri, bir oktahedronun köşelerini tanımlayan, merkezi bir atom etrafında simetrik olarak düzenlenmiş altı atomlu bileşiklerin veya atom gruplarının veya ligandların şeklini tanımlar. Oktahedronun sekiz yüzü vardır, dolayısıyla octa ön ekini alır. Oktahedron, Platonik katılardan biridir, ancak oktahedral moleküller tipik olarak merkezlerinde bir atom içerir ve ligand atomları arasında bağ yoktur. Mükemmel bir oktahedron Oh nokta grubuna aittir. Oktahedral bileşiklerin örnekleri arasında kükürt hekzaflorür SF6 ve molibden hekzakarbonil Mo (CO)6 gösterilebilir. "Oktahedral" terimi, kimyagerler tarafından, merkezi atoma olan bağların geometrisine odaklanarak ve ligandların kendi aralarındaki farklılıkları dikkate almadan biraz gevşek bir şekilde kullanılır. Örneğin, N-H bağlarının oryantasyonu nedeniyle matematiksel anlamda oktahedral olmayan [Co(NH3)6]3+, oktahedral olarak adlandırılır.

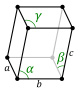
Kafes sabiti, kafes parametresi, örgü sabiti ya da örgü parametresi; bir kristal kafesindeki birim hücrelerin geometrisini belirleyen fiziksel boyut ve açıların her biridir. Bu değer, kristaldeki atomlar arasındaki mesafeyle orantılıdır. Basit kübik bir kafes, atomlar arasındaki mesafe olmak üzere yalnızca bir kafes sabitine sahipken üç boyutlu kafeslerde, kenar uzunlukları a, b ve c ile kenarların kesişimleriyle oluşan α, β ve γ olmak üzere altı kafes sabiti vardır.

Bravais kafesi, geometri ve kristalografide ni 'nin herhangi bir tam sayı olduğu ve ai'nin ilkel öteleme vektörleri veya farklı yönlerde uzanan ve kafese yayılan ilkel vektörler olduğu


Kristalografide, kristal sistemi bir dizi nokta grubudur. Kafes sistemi, bir dizi Bravais kafesidir. Uzay grupları, nokta gruplarına göre kristal sistemlere ve Bravais kafeslerine göre kafes sistemlere sınıflandırılır. Ortak bir kafes sistemine konulan uzay gruplarına sahip kristal sistemler bir kristal ailesi halinde birleştirilir.