Krezol
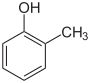


Krezol, metilfenol sınıfından organik bileşiklerdir. Çoğunlukla, doğal olarak ya da aromatik bileşiklerin üretimiyle elde edilirler. Bazen fenol ya da fenolikler olarak adlandırılırlar. Sıcaklığa bağlı olarak krezol katı ya da sıvı hâlde bulunabilir.
Krezol, en çok Lysol isimli markayla bugün tuvaletlerde dezenfekte edici olarak kullanılan keskin kokulu temizlik maddesinin kimyasal ismidir.
Krezoller (ayrıca hidroksitoluen veya metilfenoller) aromatik bileşiklerin bir grubu oluşturur. Yapı bağlı olan bir benzen halkası oluşur hidroksil (-OH) ve metil grupları (-CH3 gibi) ikame eder. Öncelikli olarak metil ile ikame edilmiş fenoller olarak kabul edilir. Ayrıca, halojenlenmiş türevleri de bulunur.
Oluşum
Krezoller ve bunların türevleri (örn. Ksilenoller) doğada yaygındır. Memelilerin idrarında, kömür ve kayın katranında olduğu kadar çeşitli mikroorganizmalarda metabolit olarak bulunurlar.
Eldesi
Başlangıçta türetilmemiş krezoller, kömür ve kayın katranından izole edildi. Trikrezol denilen sıvı, sarı-kahverengi bir izomer karışımı elde edilir. Tek damıtma, ham karbolik aside yol açar. Üç krezolün saf üretimi, sodyum hidroksit çözeltisi ile ekstraksiyon yoluyla karbolik yağ temelinde gerçekleşir. Alternatif olarak, ekstraksiyon için bir sodyum fenolat çözeltisinin ve diizopropil eterin kullanıldığı fenoraffin işlemi kullanılır.
Krezoller, toluidinlerin ilişkili diazonyum tuzunun kaynatılmasıyla sentezlenebilir.
Endüstriyel ölçekte krezoller, diğer şeylerin yanı sıra, klorotoluenin yüksek sıcaklıklarda (~250 °C) ve basınçta (~300 bar) sodyum hidroksit çözeltisi ile reaksiyona sokulmasıyla bir tüp reaktörde sentezlenir.
Özellikler
Krezoller ışığa ve havaya karşı çok hassastır. 80 °C'nin üzerindeki sıcaklıklarda hava ile patlayıcı karışımlar oluşur. Suda az çözünürler ve çok fazla kurumla yanarlar. Krezollerin katran gibi bir kokusu vardır. m-krezol, timol oluşturmak için propen ile reaksiyona girer.
pK s değeri
pK s değerleri fenolden biraz daha yüksektir. (9.99)
Reaktivite
Bununla birlikte, metil grubunun etkisine ek olarak, hidroksil grubunun etkisi, kimyasal reaktivite için daha belirleyicidir. Her iki etki de halkadaki elektron yoğunluğunu önemli ölçüde artırır . Bu nedenle krezoller, görece kolaylıkla elektrofilik aromatik ikamelere girer.
Kullanım
Krezoller, bakterisit, böcek ilacı ve mantar ilacı görevi görür. Bu nedenle genellikle dezenfektanlarda kullanılır. m-Krezol, tarımda fungisit olarak kullanılmaktadır. 8 µl/g, 30 °C depolama sıcaklığında 60 gün boyunca tahılın mantar saldırısından uzak tutulması için yeterlidir. Farmasötik bir eksipiyan olarak m-krezol, örneğin, insülin glarjinin bir bileşenidir. Tipik konsantrasyonlar, enjeksiyonluk çözelti mL'si başına 1,5 ila 3 mg aralığındadır.
Krezoller ayrıca sentetik ve boyalar, sentetik reçineler (krezol reçineler) ve ilaç yapmak için kullanılır. Gelen homeopatiye, bir ham krezol elde gelen kömür katranının, bilinen adıyla Cresolum crudum, inflamasyon, deri hastalıkları ve felç için kullanılır.
Toksikoloji
Krezol zehirlenmesi, spesifik olmayan semptomlara neden olur. Kronik zehirlenmenin belirtileri baş ağrısı, öksürük ve bulantı, iştahsızlık, yorgunluk ve uykusuzluktur. Deri yoluyla emilim çok hızlıdır. Böbrek hasarı ile akut zehirlenme ve kramplar, bilinç kaybı ve solunum felci gibi merkezî sinir sistemi bozuklukları ortaya çıkabilir. Krezollerin kanserojen olduğu düşünülmektedir.
Genel olarak fenollerde olduğu gibi, ağızdan alındığında (beyazımsı), fenollerin anestezik etkisi olduğu için ağrısız olan kimyasal yanıklar meydana gelir. İnsanlarda zehirlenme belirtileri yaklaşık 3 g'dan itibaren ortaya çıkar, yaklaşık 10 g'dan itibaren ölümcül bir şok olasılığı vardır.
Ayrıca fenollerin ve özellikle krezollerin güçlü bir protein parçalayıcı etkisi vardır. Oldukça korozif oldukları için ciltle temas hâlinde akut cilt hasarına neden olurlar, cilt hücrelerindeki proteini yok ederler ve cildin hafif asidik olan koruyucu mekanizmasının hemen üstesinden gelirler. Açık mukoza zarları (ağız boşluğu, burun, anüs) kontamine olursa, doğrudan kana karışarak vücutta hızla dağılır ve iç organlarda çok sayıda protein hasarına yol açar. Acil karşıt önlemler olmadan, krezollerin küçük miktarlarda bile yaşamı tehdit eden etkileri olabilir.
Risk değerlendirmesi
2012 yılında p -Kresol, madde değerlendirmesinin bir parçası olarak 1907/2006 (REACH) sayılı Tüzük (EC) uyarınca AB'nin devam eden eylem planına (CoRAP ) dahil edildi . Maddenin insan sağlığı ve çevre üzerindeki etkileri yeniden değerlendirilir ve gerekirse takip tedbirleri başlatılır. P- kresol alımının nedenleri, tüketici kullanımı, yüksek (toplu) tonaj ve yaygın kullanım ile ilgili endişelerin yanı sıra, CMR maddeler grubuna olası bir atamadan ve potansiyel bir endokrin bozucu olarak ortaya çıkan tehlikelerdi. Yeniden değerlendirme 2015 yılında başlamış ve Birleşik Krallık tarafından yapılmıştır. Daha sonra nihai bir rapor yayınlandı.