
Matematik ; sayılar, felsefe, uzay ve fizik gibi konularla ilgilenir. Matematikçiler ve filozoflar arasında matematiğin kesin kapsamı ve tanımı konusunda görüş ayrılığı vardır.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.
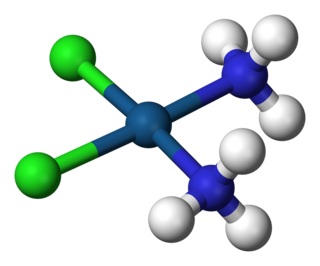
Kompleks, merkez atom olarak bir ya da birden fazla metal atomu veya iyonu ve metale bağlı ligandlardan oluşan yapıdır. Ligand, metale elektron vererek kompleks oluşturur. Metal içeren bileşiklerin birçoğu, özellikle geçiş metalleri içerenler koordinasyon bileşikleridir.
Ligand ya da ligant, merkezî bir metale bağlanan bir atom, iyon veya moleküldür. Bu bağ genelde bir veya birkaç elektron verilmesiyle oluşur, kovalent de olabilir iyonik de. Ayrıca, metal-ligand bağ değeri birden üçe kadar uzanabilir. Ligandlar genelde Lewis bazı(en) olarak sayılırlar ama ender olarak Lewis asidi ligandlar da olabilir.
Kimyada dişlilik, bir koordinasyon kompleksindeki merkezî metale bağ kurmuş ligand atomlarının sayısıdır.

Geometride tetrahedron veya dört yüzlü, dört üçgen yüzden oluşan bir çokyüzlüdür (polihedron), her köşesinde üç üçgen birleşir. Düzgün dört yüzlü dört üçgenin eşkenar olduğu bir dört yüzlüdür ve Platonik cisimlerden biridir. Dörtyüzlü, dört yüzü olan tek konveks çokyüzlüdür. Tetrahedron isminin sıfat hali "tetrahedral"dır.
Değerlik kabuğu elektron çifti itmesi kuralları moleküllerin şekillerini tahmin etmede kullanılır ve değerlik elektron çiftlerinin birbirlerini elektrostatik kuvvetle itmesi temeline dayanır. Teorinin yaratıcısı olan bilim adamlarına atfen Gillespie–Nyholm teorisi olarak da adlandırılır. "VSEPR" kısaltması kimi zaman "vespır" olarak da telaffuz edilebilir.
Teoriye göre atomları çevreleyen değerlik elektron çiftleri birbirlerini iterek aralarındaki itme kuvvetini en aza indirirler ve böylece moleküle şeklini verirler. Merkez atoma bağlı atomların sayısı ile bağ yapmamış elektron çiftlerinin sayısının toplamı sterik numarayı verir.

Hesaplamalı geometri, geometri açısından ifade edilebilen algoritmaların incelenmesine ayrılmış bilgisayar bilimlerinin bir dalıdır. Bazı çalışmalar tamamen geometrik problemlerden meydana gelirken bazıları ise hesaplamalı geometrik algoritmaların incelenmesi sonucunda meydana gelmektedir. Bunun gibi problemlerin hesaplama geometrisinin bir parçası olduğu düşünülmektedir. Modern hesaplamalı geometri son zamanlarda gelişme göstermesine karşın, tarihin antik dönemine kadar uzanan en eski bilgi işlem alanlarından biridir.

Kimyada, doğrusal moleküler geometri 180°'lik bir açıya yerleştirilmiş diğer iki atoma bağlanmış merkezi bir atom etrafındaki geometriyi tarif eder. Asetilen (HC≡CH) gibi doğrusal organik moleküller genellikle karbon merkezleri için sp orbital hibridizasyonu teşvik edilerek tarif edilir.
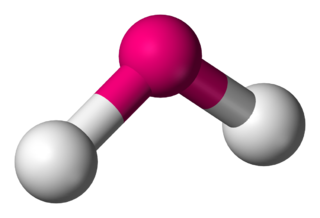
Kimyada, " açısal" ya da "bükülmüş" terimi bazı moleküllere moleküler geometrilerini tanımlamak için kullanılabilir. Oksijen gibi bazı atomlar, Elektron dizilimi nedeniyle hemen hemen her zaman iki (veya daha fazla) kovalent bağını doğrusal olmayan yönlerde ayarlarlar. Su (H2O), analoglarının yanı sıra açısal bir molekül örneğidir. İki hidrojen atomu arasındaki bağ açısı yaklaşık olarak 104,45°'dir. Doğrusal olmayan geometri genel olarak sadece ana grup elementleri içeren diğer üç atomlu molekülleri ve iyonlar için gözlemlenir, belirgin örnekler: Azot dioksit (NO2), kükürt diklorür (SCL2) ve metilen (CH2).

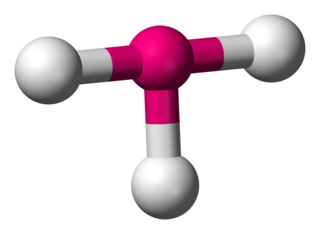
Kimyada, üçgen düzlemsel, merkezde bir atom ve birer üçgenin köşelerinde üç atom olan ve hepsi bir düzlemde çevresel atomlar olarak bulunduğu bir moleküler geometri modelidir. İdeal bir üçgen düzlemsel türde, üç ligand aynıdır ve bütün bağ açıları 120°'dir. Bu türler D3h nokta grubuna aittir. Üç ligandın aynı olmaadığı H2CO gibi moleküller, bu ideal geometri sapma gösterir. Üçgen düzlemsel bir şekle sahip moleküller arasında boron triflorür (BF3), formaldehit (H2CO), fosgen (COCl2) ve kükürt trioksit (SO3) bulunmaktadır. Üçgen düzlem geometrisi olan bazı iyonlar arasında nitrat (NO3-), karbonat (CO3−2) ve guanidinyum (C(NH2)3+)) bulunmaktadır. Organik kimyada, üçgen düzlemsel olarak karbon merkezlerine üç bağlı atomun bulunduğu moleküller çoğunlukla sp2 hibridizasyona sahip olarak tarif edilmiştir.

Kimyada üçgen piramit, apekste bir atomun ve dört yüzlüyü andıran üçgen temelin köşelerinde üç atomun bulunduğu moleküler geometridir (dörtyüzlü moleküler geometri ile karıştırılmamalıdır). Köşelerdeki üç atomun hepsi aynı olduğunda, molekül C3v nokta grubuna aittir. Üçgen piramit geometrisi olan bazı moleküller ve iyonlar; azot grubu hidritler (XH3), ksenon trioksit (XeO3), klorat iyonu ClO3- ve sülfit iyonu SO3−2. Organik kimyada, üçgen piramit geometriye sahip moleküller bazen sp3 hibridize olarak açıklanmaktadır. AXE yöntemi için Vsepr teori sınıflandırması AX3E1'dir.
Kimyada, T-şeklindeki moleküler geometri, merkezi bir atomun üç liganda sahip olduğu bazı moleküllerin yapılarını açıklar. Normalde, üç koordineli bileşikler üçgen düzlemsel veya piramidal geometrileri kullanır. T-şekilli moleküllerin örnekleri arasında, halojen triflorürler vardır, örneğin ClF3.
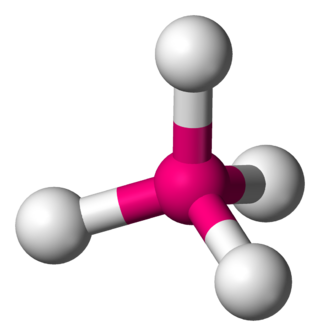
Dörtyüzlü veya tetrahedral molekül geometrisi, merkezi atomun, dört yüzlünün ortasında, dört köşede ise sübstitüentlerin yer aldığı molekül geometrisidir. Bağ açıları, dört sübstitüent aynı olduğunda (örn. metan CH4 ya da daha ağır analogları) cos−1 (-⅓) = 109,4712206 ...° ≈ 109.5° olur. Metan veya diğer simetrik yüzlü moleküller Td nokta grubuna aittir, ama dörtyüzlü moleküller genellikle düşük simetriye sahiptir. Tetrahedral moleküller kiral olabilir.
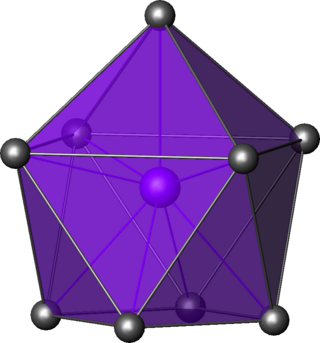
Kimyada, kepli kare antiprizmatik moleküler geometri, bir jiro-uzatılmış kare piramidin köşelerini tanımlayan dokuz atomun, atom gruplarının veya ligandların merkezi bir atomun etrafına yerleştirildiği bileşiklerin şeklini tanımlar.

Kimyada, çift kepli üçgen prizmatik moleküler geometri, sekiz atom, atom grupları veya ligand gruplarının, çift-taraflı bir üçgen prizmanın köşelerini tanımlayan merkezi bir atomun etrafına yerleştirildiği bileşiklerin şeklini açıklar. Bu şekil, C2v olan simetri ile birlikte, okta-koordine geçiş metali kompleksleri için kare antiprizma ve onikiyüzlü ile birlikte üç genel biçimlerinden bir tanesidir.

Kimyada, oktahedral moleküler geometri, bir oktahedronun köşelerini tanımlayan, merkezi bir atom etrafında simetrik olarak düzenlenmiş altı atomlu bileşiklerin veya atom gruplarının veya ligandların şeklini tanımlar. Oktahedronun sekiz yüzü vardır, dolayısıyla octa ön ekini alır. Oktahedron, Platonik katılardan biridir, ancak oktahedral moleküller tipik olarak merkezlerinde bir atom içerir ve ligand atomları arasında bağ yoktur. Mükemmel bir oktahedron Oh nokta grubuna aittir. Oktahedral bileşiklerin örnekleri arasında kükürt hekzaflorür SF6 ve molibden hekzakarbonil Mo (CO)6 gösterilebilir. "Oktahedral" terimi, kimyagerler tarafından, merkezi atoma olan bağların geometrisine odaklanarak ve ligandların kendi aralarındaki farklılıkları dikkate almadan biraz gevşek bir şekilde kullanılır. Örneğin, N-H bağlarının oryantasyonu nedeniyle matematiksel anlamda oktahedral olmayan [Co(NH3)6]3+, oktahedral olarak adlandırılır.

Bir geometrici, çalışma alanı geometri olan matematikçidir.
Pauling'in kuralları,1929'da Linus Pauling tarafından iyonik bileşiklerin kristal yapılarını tahmin etmek ve rasyonelleştirmek için yayınlanan beş kuraldır.

Geometri, şekil, boyut, şekillerin göreceli konumu ve uzayın özellikleri ile ilgili sorularla ilgilenen bir matematik dalıdır. Geometri, en eski matematiksel bilimlerden biridir.















