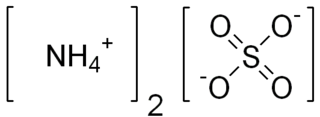Kobalt(II) sülfat

Kobalt(II) sülfat; CoSO4(H2O)x formülüne sahip inorganik bileşiklerden herhangi birine verilen isimdir. Genellikle sırasıyla kobalt sülfat, heksa- veya heptahidratları (CoSO4.6H2O or CoSO4.7H2O) tanımlar. Heptahidrat, suda ve metanolde çözünen kırmızı bir katıdır. Kobalt(II) tek sayıda elektrona sahip olduğu için tuzları paramanyetiktir.
Hazırlama ve yapı
Metalik kobaltın, oksidinin, hidroksitinin veya karbonatın sulu sülfürik asitle reaksiyonuyla oluşur:[1]
- Co + H2SO 4 + 7 H2O → CoSO 4 (H2O) 7 + H2
- CoO + H2SO 4 + 6 H2O → CoSO 4 (H2O) 7
Heptahidrat sadece oda sıcaklığında >%70 nemde kararlıdır aksi halde hekzahidrata dönüşür.[2] Heksahidrat 100 °C ve 250 °C de, sırasıyla monohidrata ve anhidröz formlara dönüşür.
- CoSO 4 (H 2 O) 7 → CoSO 4 (H 2 O) 6 + H 2 O
- CoSO 4 (H 2 O) 6 → CoSO 4 (H 2 O) + 5 H 2 O
- CoSO 4 (H 2 O) → CoSO 4 + H 2 O
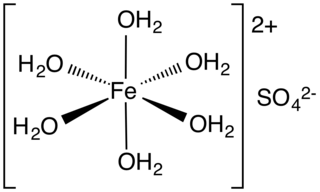
Hekzahidrat, sülfat anyonlarıyla ilişkili oktahedral [Co(H2O)6 ] 2+ iyonlarından oluşan bir metal sulu kompleksidir.[3] Monoklinik heptahidrat ayrıca X-ışını kristalografisi ile tanımlanmıştır. Ayrıca [Co(H2O)6 ] 2+ oktahedranın yanı sıra bir kristalleşme suyu içerir.[2]
Kullanımlar ve reaksiyonlar
Kobalt sülfatlar, kobaltın cevherlerinden çıkarılmasında önemli ara maddelerdir. Böylece, kırılmış, kısmen rafine edilmiş cevherler, kobalt sülfat içeren kırmızı renkli çözeltiler verecek şekilde sülfürik asitle işlenir.[1]
Hidratlı kobalt(II) sülfat, diğer kobalt tuzlarının yapımında olduğu gibi, pigmentlerin hazırlanmasında da kullanılır. Kobalt pigmenti porselen ve camda kullanılır. Kobalt(II) sülfat, akümülatörlerde ve galvanik kaplama banyolarında, sempatik mürekkeplerde ve toprak ve hayvan yemlerine katkı maddesi olarak kullanılır. Bu amaçlar için kobalt sülfat, kobalt oksidin sülfürik asitle işlenmesiyle üretilir.
Ticari amaçla yaygın olarak bulunabilen heptahidrat, koordinasyon kimyasında rutin bir kobalt kaynağıdır.[4]
Doğal oluşum
Nadiren kobalt(II) sülfat, birincil Co mineralleri (skutterudit veya kobaltit gibi) içeren oksidasyon bölgeleri arasında meydana gelen birkaç kristallohidrat minerali formunda bulunur. Bu mineraller: biebierit (heptahidrat), moorhouseit (Co,Ni,Mn)SO4 . 6H2O,[5][6] aplovit (Co,Mn,Ni)SO4 . 4H2O ve kobalkieserittir (monohidrat).[6][7][8]
Sağlık
Kobalt, memeliler için gerekli bir mineraldir ancak günde birkaç mikrogramdan fazlası zararlıdır. Zehirlenmeler nadiren kobalt bileşiklerinden kaynaklansa da, ölümcül dozdan çok daha düşük dozlarda kronik alımı ciddi sağlık sorunlarına neden olmuştur. 1965'te Kanada'da bira köpüğünü stabilize etmek için bir kobalt bileşiğinin kullanılması, bira içen kardiyomiyopatisi olarak bilinen toksin kaynaklı özel bir kardiyomiyopatiye neden olmuştur.[9][10][11]
Ayrıca, Uluslararası Kanser Araştırma Ajansı (IARC) Monograflarına göre kobalt(II) sülfatın kansere (muhtemelen kanserojen, IARC Grup 2B ) neden olduğundan şüphelenilmektedir.[12]
Bağıntılı bileşikler
- Tutton tuzu K2Co(SO4)2 · 6 H2O
Kaynakça
- ^ a b Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a07_281.pub2.Donaldson, John Dallas; Beyersmann, Detmar (2005). "Cobalt and Cobalt Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a07_281.pub2.
- ^ a b Redhammer (2007). "Co2+-Cu2+ Substitution in Bieberite Solid-Solution Series, (Co1−xCux)SO4 · 7H2O, 0.00 ≤ x ≤ 0.46: Synthesis, Single-Crystal Structure Analysis, and Optical Spectroscopy". American Mineralogist. 92 (4): 532-545. doi:10.2138/am.2007.2229.
- ^ Elerman, Y. "Refinement of the Crystal Structure of CoSO4 · 6H2O" Acta Crystallographica Section C 1988, volume 44, p599-p601. DOI:10.1107/S0108270187012447
- ^ Resolution of the Tris(ethylenediamine)cobalt(III) Ion. Inorganic Syntheses. 6. 1950. ss. 183-186. doi:10.1002/9780470132371.ch58. ISBN 9780470132371.
- ^ "Moorhouseite". 21 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Mart 2023.
- ^ a b "List of Minerals". 21 Mart 2011. 20 Aralık 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Mart 2023.
- ^ "Cobaltkieserite". 21 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Mart 2023.
- ^ "Bieberite". 21 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Mart 2023.
- ^ Morin Y (1969). "Quebec beer-drinkers' cardiomyopathy: Clinical and hemodynamic aspects". Annals of the New York Academy of Sciences. 156 (1): 566-576. doi:10.1111/j.1749-6632.1969.tb16751.x. PMID 5291148.
- ^ Barceloux, Donald G. (1999). "Cobalt". Clinical Toxicology. 37 (2): 201-216. doi:10.1081/CLT-100102420. PMID 10382556.
- ^ "11.1.5 The unusual type of myocardiopathy recognized in 1965 and 1966 in Quebec (Canada), Minneapolis (Minnesota), Leuven (Belgium), and Omaha (Nebraska) was associated with episodes of acute heart failure (e/g/, 50 deaths among 112 beer drinkers)". 1 Mart 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 21 Mart 2023.
- ^ "Cobalt in Hard Metals and Cobalt Sulfate, Gallium Arsenide, Indium Phosphide and Vanadium Pentoxide" (PDF). IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. 1 Mart 2023 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 21 Mart 2023.