Kobalt
Kobalt (Co) | |
| Temel özellikleri | |
|---|---|
| Atom numarası | 27 |
| Element serisi | Geçiş metalleri |
| Grup, periyot, blok | 9, 4, d |
| Görünüş | Hafif gri tonda metalik  |
| Kütle numarası | 58.933195(5) g/mol |
| Elektron dizilimi | [Ar] 3d7 4s2 |
| Enerji seviyesi başına Elektronlar | 2, 8, 15, 2 |
| CAS kayıt numarası | 7440-48-4 |
| Fiziksel Özellikleri | |
| Maddenin hâli | Katı |
| Yoğunluk | (0 °C, 101.325 kPa) 8.90 g/cm³ |
| Sıvı hâldeki yoğunluğu | 7.75 g/cm³ |
| Ergime noktası | 1768 °K 1495 °C |
| Kaynama noktası | 3200 °K 2927 °C |
| Ergime ısısı | 16.06 kJ/mol |
| Buharlaşma ısısı | 377 kJ/mol |
| Isı kapasitesi | 24.81 J/(mol·K) |
| Atom özellikleri | |
| Kristal yapısı | hexagonal |
| Yükseltgenme seviyeleri | ? |
| Elektronegatifliği | 1.88 Pauling ölçeği |
| İyonlaşma enerjisi | ? kJ/mol |
| Atom yarıçapı | 125 pm |
| Atom yarıçapı (hes.) | ? pm |
| Kovalent yarıçapı | ? pm |
| Van der Waals yarıçapı | ? pm |
| Diğer özellikleri | |
| Elektrik direnci | ? nΩ·m (20°C'de) |
| Isıl iletkenlik | ? W/(m·K) |
| Isıl genleşme | ? µm/(m·K) (25°C'de) |
| Ses hızı | ? m/s (?'de) |
| Mohs sertliği | 5.0 |
| Vickers sertliği | 1043 MPa |
| Brinell sertliği | ? MPa |

Kobalt kimyasal bir element'tir. Sembol'ü Co ve atom numarası 27'dir. Nikel gibi kobalt da, doğal meteorik demir alaşımlarında bulunan küçük birikintiler dışında, yer kabuğunda yalnızca kimyasal olarak birleşik formda bulunur. İndirgeyici eritme yoluyla üretilen serbest element sert, parlak, gümüş rengi bir metal'dir.
Kobalt bazlı mavi pigmentler (kobalt mavisi), antik çağlardan beri takı ve boyalarda ve cama ayırt edici mavi renk tonu vermek için kullanılır.
Rengin uzun süre metal bizmut'tan kaynaklandığı düşünülüyordu. Madenciler uzun zamandır mavi pigment üreten mineral'lerin bazıları için kobold cevheri (Almanca goblin cevheri) adını kullanmışlardı. Bilinen metaller açısından zayıf oldukları ve eritildiğinde arsenik içeren zehirli dumanlar çıkardıkları için bu şekilde adlandırılmışlardı.[1] 1735 yılında, bu tür cevherlerin yeni bir metale (antik çağlardan beri keşfedilen ilk metal) indirgenebildiği keşfedildi ve bu metale sonuçta kobold adı verildi.
Günümüzde bazı kobalt, kobaltit (CoAsS) gibi metalik parlaklığa sahip bir dizi cevherden özel olarak üretilir. Element daha çok bakır ve nikel madenciliğinin bir yan ürünü olarak üretilir.
Demokratik Kongo Cumhuriyeti (DKC) ve Zambiya'daki Bakır Kuşağı, küresel kobalt üretiminin çoğunu yapar. 2016 yılında dünya üretimi 116,000 ton (114,168 emperyal ton; 127,868 küçük ton) (114.000 uzun ton; 128.000 kısa ton) idi (Kanada Doğal Kaynakları'na göre) ve tek başına DKC %50'den fazlasını üretmiştir.[2]
Kobalt öncelikle Lityum iyon pil'lerde ve manyetik, aşınmaya dayanıklı ve yüksek mukavemetli alaşım'ların üretiminde kullanılır.
Kobalt silikat ve kobalt(II) alüminat (CoAl2O4, kobalt mavisi) bileşikleri cam'a, seramik'lere, mürekkep'lere, boya'lara ve vernik'lere belirgin koyu bir mavi renk verir.
Kobalt doğal olarak tek kararlı izotop olan kobalt-59 olarak oluşur. Kobalt-60, radyoaktif izleyici olarak ve yüksek enerjili gama ışınlarının üretiminde kullanılan, ticari açıdan önemli bir radyoizotoptur. Kobalt ayrıca petrol endüstrisinde ham petrolün rafine edilmesinde katalizör olarak da kullanılır. Bu, yakıldığında çok kirletici ve asit yağmurlarına neden olan kükürtten arındırmak içindir.[3]
Kobalt, kobalaminler adı verilen bir grup koenzim'in aktif merkezidir. Bu türün en bilinen örneği olan Vitamin B12, tüm hayvanlar için vazgeçilmez bir vitamin'dir. İnorganik formdaki kobalt aynı zamanda bakteri, su yosunları ve mantarlar için de mikro besin'dir.
Özellikler

Kobalt, özgül ağırlığı 8,9 olan ferromanyetik bir metaldir. Curie sıcaklığı 1.115 °C (2.039 °F)[4] ve manyetik momenti atom başına 1,6–1,7 Bohr magneto'ndur.[5] Kobalt, demir'in üçte ikisi kadar göreceli geçirgenliğe sahiptir.[6]
Metalik kobalt iki kristalografik yapı halinde oluşur: Altıgen sıkı paket (hcp) ve Yüzey merkezli kübik fcc. Hcp ve fcc yapıları arasındaki ideal geçiş sıcaklığı 450 °C (842 °F) ancak pratikte aralarındaki enerji farkı o kadar azdır ki ikisinin rastgele büyümesi yaygındır.[7][8][9]
Kobalt, pasifleştirici bir oksit filmi ile oksitlenmesinden korunan zayıf indirgeyici bir metaldir. Halojen'lerin ve kükürt'ün saldırısına uğrar. Oksijen'de ısıtma, 900 °C'de (1.650 °F) oksijeni kaybederek monoksit CoO'yu veren Co3O4'ü üretir.[10] Metal, F3'ü vermek üzere 520 K'de flor (F2) ile reaksiyona girer; klor (Cl2), brom (Br2) ve iyot (I2) ile eşdeğer ikili halojenür'ler üretir. Isıtıldığında bile hidrojen gazı (H2) veya azot gazı (N2) ile reaksiyona girmez ancak bor, karbon, fosfor, arsenik ve kükürt ile reaksiyona girer.[11] Normal sıcaklıklarda mineral asitlerle yavaş, nemli fakat kuru olmayan havayla ise çok yavaş reaksiyona girer.
Bileşikler
Kobaltın yaygın yükseltgenme durum'ları +2 ve +3'ü içerir ancak oksidasyon durumları −3 ila +5 arasında değişen bileşikler de bilinir. Basit bileşikler için yaygın bir oksidasyon durumu +2'dir (kobalt(II)). Bu tuzlar suda pembe renkli metal su kompleksi [Co(H2O)6]2+ oluşturur. Klorür ilavesi yoğun mavi [CoCl4]2- verir.[12] Boraks boncuklarında alev testi, kobalt hem oksitleyici hem de indirgeyici alevlerde koyu mavi renk gösterir.[13]
Oksijen ve kalkojen bileşikleri
Kobaltın birkaç oksit'i bilinmektedir. Yeşil kobalt (II) oksit (CoO) kaya tuzu yapılıdır.
Su ve oksijenle kolayca kahverengi kobalt(III) hidroksite (Co(OH)3) oksitlenir.
600–700 °C sıcaklıklarda CoO, spinel yapıya sahip mavi kobalt(II, III) okside (Co3O4) oksitlenir.[12]
Siyah kobalt(III) oksit (Co2O3) de bilinmektedir.[14]
Kobalt oksitler düşük sıcaklık'ta antiferromanyetik'tir:CoO (Néel sıcaklığı 291 K) ve Co3O4 (Néel sıcaklığı: 40 K), +2 ve +3 oksidasyon durumlarının karışımıyla manyetit'e (Fe3O4) benzer.[15]
Kobaltın başlıca kalkojenürleri arasında siyah kobalt(II) sülfürler, pirit benzeri bir yapı benimseyen CoS2 ve kobalt(III) sülfür (Co2S3) bulunur.
Halidler

Kobalt(II)'nin dört dihalojenürü bilinmektedir: kobalt(II) florür (CoF2, pembe), kobalt(II) klorür (CoCl2, mavi), kobalt(II) bromür (CoBr2 yeşil), kobalt(II) iyodür (CoI2, Mavi-siyah). Bu halojenürler susuz ve hidratlı formlarda bulunur. Susuz diklorür mavi iken hidrat kırmızıdır.[16] Co3+ reaksiyonunun indirgeme potansiyeli + e− → Co2+ +1,92 V'tur, klor'dan klorüre olan değer +1,36 V'un ötesindedir. Sonuç olarak kobalt(III) klorür kendiliğinden kobalt(II) klorür ve klora indirgenir. Florun florüre indirgenme potansiyeli +2,87 V kadar yüksek olduğundan, kobalt(III) florür birkaç basit kararlı kobalt(III) bileşiğinden biridir. Bazı florlama reaksiyonlarında kullanılan kobalt(III) florür su ile kuvvetli reaksiyona girer.[10]
Koordinasyon bileşikleri
Tüm metallerde olduğu gibi, kobaltın moleküler bileşikleri ve çok atomlu iyonları, koordinasyon kompleksi'leri yani bir veya daha fazla ligand'a bağlı kobalt içeren moleküller veya iyonlar olarak sınıflandırılır. Bunlar potansiyel olarak sonsuz çeşitlilikte molekül ve iyonların kombinasyonları olabilir, örneğin:
- su H2O, katyon hexaaquocobalt(II)'de olduğu gibi [Co(H2O)6]2+. Bu pembe renkli kompleks, x = 6 veya 7 ile katı kobalt sülfattaki CoSO4. (H2O)x baskın katyondur. ve bunların su çözeltileri.
- amonyak NH3, cis-diaquotetraamminecobalt(III)’de olduğu gibi [Co(NH3)4(H2O)2]3+, heksolde [Co(Co(NH3)4(HO)2)3]6-, [Co(NO2)4(NH3)2]-’de (Erdmann tuz anyonu),[17] ve [Co(NH3)5(CO3)]-’de.[17]
- karbonat [CO3]2-, yeşil triskarbonatokobaltat(III) [Co(CO3)3]3- ‘deki gibi anyon.[17][18][19]
- nitrit [NO2]- [Co(NO2)4(NH3)2]-’de olduğu gibi.[17]
- hidroksit [HO]-, heksol’deki gibi.
- klorür [Cl]-, tetrakloridokobaltat(II) CoCl4]2-’deki gibi.
- bikarbonat [HCO3]-, [Co(CO3)2(HCO3)(H2O)]3-’deki gibi.[17]
- oksalat [C2O4]2-, trisoksalatokobaltat(III) [Co(C2O4)3-3]’deki gibi.[17]
Bu bağlı gruplar, elektronegatiflik ve sertlik-yumuşaklık genel prensiplerine göre kobalt atomlarının oksidasyon durumlarının stabilitesini etkiler. Örneğin Co3+ kompleksleri amin ligandlarına sahip olma eğilimindedir. Fosfor azottan daha yumuşak olduğundan, fosfin ligandları yumuşak Co2+ ve Co+ özelliğine sahip olma eğilimindedir; bunun bir örneği tris(trifenilfosfin)kobalt(I) klorürdür (P(C6H5)3)3CoCl). Daha elektronegatif (ve daha sert) oksit ve florür, Co4+ ve Co5+ türevlerini stabilize edebilir; ör. sezyum heksaflorokobaltat(IV) (Cs2CoF6) ve potasyum perkobaltat (K3CoO4).[10]
Koordinasyon kimyasında Nobel ödüllü bir öncü olan Alfred Werner, ampirik formül’lü bileşiklerle çalıştı [Co(NH3)6]3+. Belirlenen izomerlerden biri kobalt(III) hekzammin klorürdü. Tipik bir Werner tipi kompleks olan bu koordinasyon kompleksi, altı amin ortogonal ligandı ve üç klorür karşı anyonu tarafından koordine edilen merkezi bir kobalt atomundan oluşur. Amonyak yerine şelatlayıcı etilendiamin ligandlarının kullanılması tris(etilendiamin)kobalt(III) ([Co(en)3]3+), optik izomerlere çözülen ilk koordinasyon komplekslerinden biriydi. Kompleks, "üç kanatlı pervanenin" sağ ve sol yönlü formlarında mevcuttur. Bu kompleks ilk olarak Werner tarafından sarı-altın iğneye benzer kristaller halinde izole edildi.[20][21]
Organometalik bileşikler
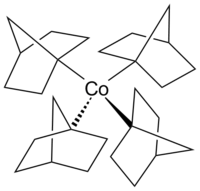
Kobaltosen, demir yerine kobalt içeren, ferrosen'in yapısal bir analoğu'dur. Kobaltosen oksidasyona ferrosenden çok daha duyarlıdır..[22] Kobalt karbonil (Co2(CO)8), karbonilasyon ve hidrosililasyon reaksiyonlarında bir katalizör’dür.[23] B12 Vitamini (aşağıya bakın) doğada bulunan organometalik bir bileşiktir ve metal atomu içeren tek vitamin’dir.[24] Kobaltın normalde alışılmadık +4 oksidasyon durumundaki bir alkilkobalt kompleksinin bir örneği, β-hidrojen eliminasyonuna karşı direnciyle dikkat çeken bir geçiş metali-alkil kompleksi olan homoleptik kompleks tetrakis(1-norbornil)kobalt(IV) (Co(1-norb)4)'tür.[25]. Kobalt(III) ve kobalt(V) kompleksleri [Li(THF)4]+[Co(1-norb)4]- ve [Co(1-norb)4]+[BF4]- da biliniyor.[26]
Uygulamalar
Kobalt bazlı alaşımlar ayrıca korozyon’a ve aşınmaya dirençlidir bu nedenle titanyum gibi zamanla aşınmayan ortopedik implantlar yapmak için kullanışlıdır. Aşınmaya dayanıklı kobalt alaşımlarının gelişimi 20. yüzyılın ilk on yılında, değişen miktarlarda tungsten ve karbon içeren krom içeren stellite alaşımlarıyla başladı. Krom ve tungsten karbür içeren alaşımlar çok serttir ve aşınmaya dayanıklıdır.[27]
Protez parçalar (kalça ve diz protezleri) için Vitallium gibi özel kobalt-krom-molibden alaşımları kullanılır.[28]
Kobalt alaşımları aynı zamanda diş protezlerinde, alerjik olabilen nikel yerine yararlı bir alternatif olarak kullanılır.[29]
Bazı yüksek hız çelikleri ayrıca ısı ve aşınma direncini arttırmak için kobalt içerir. Kalıcı mıknatıs’larda, Alnico olarak bilinen alüminyum, nikel, kobalt ve demir ile samaryum ve kobaltın (samaryum-kobalt mıknatısı) özel alaşımları kullanılır.[30] Aynı zamanda mücevherat için %95 platin ile alaşımlanarak hassas döküm için uygun ve aynı zamanda hafif manyetik olan bir alaşım elde edilir.[31]
Kobalt iki ya da fazla bileşenli toz metallerin yapıştırılmasında ve kesici takımlarda kullanılır.
Tarihçe
Kobalt 1773 yılında Georg Brandt tarafından keşfedilmiştir.
Üretim

| Ülke | Üretim | Rezervler |
|---|---|---|
| 130.000 | 4.000.000 | |
| 10.000 | 600.000 | |
| 8.900 | 250.000 | |
| 5.900 | 1.500.000 | |
| 3.900 | 220.000 | |
| 3.800 | 500.000 | |
| 3.800 | 260.000 | |
| 3.000 | 100.000 | |
| 3.000 | 47.000 | |
| 2.700 | 36.000 | |
| 2.300 | 13.000 | |
| 2.200 | 140.000 | |
| 800 | 69.000 | |
| Diğer ülkeler | 5.200 | 610.000 |
| Dünya toplamı | 190.000 | 8.300.000 |
Kobaltın ana cevherleri kobaltit, eritrit, glokodot ve skutterudittir, ancak kobaltın çoğu nikel ve bakır madenciliği ve eritme işlemlerinin kobalt yan ürünlerinin indirgenmesiyle elde edilir.[33][34]
Co(OH)3 ısıtılarak Co2O3 oksidine dönüştürülür. Daha sonra bu oksit karbon ile indirgenerek saf kobalt elde edilir.

İzotopları
Kaynakça
- ^ Şablon:Cite OED2
- ^ Danielle Bochove (1 Kasım 2017). "Electric car future spurs Cobalt rush: Swelling demand for product breathes new life into small Ontario town". Vancouver Sun. Bloomberg. 28 Temmuz 2019 tarihinde kaynağından arşivlendi.
- ^ "Catalysts". Cobalt Institute. 16 Ağustos 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 15 Ağustos 2023.
- ^ Enghag, Per (2004). "Cobalt". Encyclopedia of the elements: technical data, history, processing, applications. Wiley. s. 667. ISBN 978-3-527-30666-4.
- ^ Murthy, V. S. R (2003). "Magnetic Properties of Materials". Structure And Properties Of Engineering Materials. McGraw-Hill Education (India) Pvt Limited. s. 381. ISBN 978-0-07-048287-6.
- ^ Celozzi, Salvatore; Araneo, Rodolfo; Lovat, Giampiero (1 Mayıs 2008). Electromagnetic Shielding. Wiley. s. 27. ISBN 978-0-470-05536-6.
- ^ Lee, B.; Alsenz, R.; Ignatiev, A.; Van Hove, M.; Van Hove, M. A. (1978). "Surface structures of the two allotropic phases of cobalt". Physical Review B. 17 (4): 1510-1520. Bibcode:1978PhRvB..17.1510L. doi:10.1103/PhysRevB.17.1510.
- ^ "Properties and Facts for Cobalt". American Elements. 2 Ekim 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 19 Eylül 2008.
- ^ Cobalt. Brüksel: Centre d'Information du Cobalt. 1966. s. 45.
- ^ a b c Holleman, A. F.; Wiberg, E.; Wiberg, N. (2007). "Cobalt". Lehrbuch der Anorganischen Chemie (Almanca) (102nd bas.). de Gruyter. ss. 1146-1152. ISBN 978-3-11-017770-1.
- ^ Şablon:Housecroft3rd
- ^ a b Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. bas.). Butterworth-Heinemann. ss. 1117–1119. ISBN 0080379419.
- ^ Rutley, Frank (6 Aralık 2012). Rutley's Elements of Mineralogy (İngilizce). Springer Science & Business Media. s. 40. ISBN 978-94-011-9769-4.
- ^ Krebs, Robert E. (2006). The history and use of our earth's chemical elements: a reference guide (2.2yayıncı=Greenwood Publishing Group bas.). s. 107. ISBN 0-313-33438-2.
- ^ Petitto, Sarah C.; Marsh, Erin M.; Carson, Gregory A.; Langell, Marjorie A. (2008). "Cobalt oxide surface chemistry: The interaction of CoO(100), Co3O4(110) and Co3O4(111) with oxygen and water". Journal of Molecular Catalysis A: Chemical. 281 (1–2): 49-58. doi:10.1016/j.molcata.2007.08.023. 2 Ağustos 2023 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Ocak 2024.
- ^ Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2. bas.). Butterworth-Heinemann. ss. 1119–1120. ISBN 0080379419.
- ^ a b c d e f Thomas P. McCutcheon and William J. Schuele (1953): "Complex Acids of Cobalt and Chromium. The Green Carbonatocobalt(III) Anion". Journal of the American Chemical Society, volume 75, issue 8, pages 1845–1846. DOI:10.1021/ja01104a019
- ^ H. F. Bauer and W. C. Drinkard (1960): "A General Synthesis of Cobalt(III) Complexes; A New Intermediate, Na3[Co(CO3)3]·3H2O". Journal of the American Chemical Society, volume 82, issue 19, pages 5031–5032. DOI:10.1021/ja01504a004.
- ^ Fikru Tafesse, Elias Aphane, and Elizabeth Mongadi (2009): "Determination of the structural formula of sodium tris-carbonatocobaltate(III), Na3[Co(CO3)3]·3H2O by thermogravimetry". Journal of Thermal Analysis and Calorimetry, volume 102, issue 1, pages 91–97. DOI:10.1007/s10973-009-0606-2
- ^ Werner, A. (1912). "Zur Kenntnis des asymmetrischen Kobaltatoms. V". Chemische Berichte. 45: 121-130. doi:10.1002/cber.19120450116. 13 Mart 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 13 Ocak 2024.
- ^ Gispert, Joan Ribas (2008). "Early Theories of Coordination Chemistry". Coordination chemistry. Wiley. ss. 31-33. ISBN 978-3-527-31802-5. 5 Mayıs 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 27 Haziran 2015.
- ^ James E. House (2008). Inorganic chemistry. Academic Press. ss. 767-. ISBN 978-0-12-356786-4. Erişim tarihi: 16 Mayıs 2011.
- ^ Charles M. Starks; Charles Leonard Liotta; Marc Halpern (1994). Phase-transfer catalysis: fundamentals, applications, and industrial perspectives. Springer. ss. 600-. ISBN 978-0-412-04071-9. Erişim tarihi: 16 Mayıs 2011.
- ^ Sigel, Astrid; Sigel, Helmut; Sigel, Roland, (Ed.) (2010). Organometallics in Environment and Toxicology (Metal Ions in Life Sciences). Cambridge, UK: Royal Society of Chemistry Publishing. s. 75. ISBN 978-1-84755-177-1.
- ^ Byrne, Erin K.; Richeson, Darrin S.; Theopold, Klaus H. (1 Ocak 1986). "Tetrakis(1-norbornyl)cobalt, a low spin tetrahedral complex of a first row transition metal". Journal of the Chemical Society, Chemical Communications (İngilizce) (19): 1491. doi:10.1039/C39860001491. ISSN 0022-4936.
- ^ Byrne, Erin K.; Theopold, Klaus H. (1 Şubat 1987). "Redox chemistry of tetrakis(1-norbornyl)cobalt. Synthesis and characterization of a cobalt(V) alkyl and self-exchange rate of a Co(III)/Co(IV) couple". Journal of the American Chemical Society. 109 (4): 1282-1283. doi:10.1021/ja00238a066. ISSN 0002-7863.
- ^ Campbell, Flake C (30 Haziran 2008). "Cobalt and Cobalt Alloys". Elements of metallurgy and engineering alloys. ASM International. ss. 557-558. ISBN 978-0-87170-867-0.
- ^ Michel, R.; Nolte, M.; Reich M.; Löer, F. (1991). "Systemic effects of implanted prostheses made of cobalt-chromium alloys". Archives of Orthopaedic and Trauma Surgery. 110 (2): 61-74. doi:10.1007/BF00393876. PMID 2015136.
- ^ Disegi, John A. (1999). Cobalt-base Aloys for Biomedical Applications. ASTM International. s. 34. ISBN 0-8031-2608-5.
- ^ Luborsky, F. E.; Mendelsohn, L. I.; Paine, T. O. (1957). "Reproducing the Properties of Alnico Permanent Magnet Alloys with Elongated Single-Domain Cobalt-Iron Particles". Journal of Applied Physics. 28 (344): 344. Bibcode:1957JAP....28..344L. doi:10.1063/1.1722744.
- ^ Biggs, T.; Taylor, S. S.; Van Der Lingen, E. (2005). "The Hardening of Platinum Alloys for Potential Jewellery Application". Platinum Metals Review. 49: 2-15. doi:10.1595/147106705X24409
 .
. - ^ Kobalt İstatistikleri ve Bilgileri (PDF), U.S. Geological Survey, 2023, 8 June 2023 tarihinde kaynağından arşivlendi (PDF), erişim tarihi: 13 January 2024
- ^ Shedd, Kim B. "Mineral Yearbook 2006: Cobalt" (PDF). United States Geological Survey. 10 Ocak 2019 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 26 Ekim 2008.
- ^ Shedd, Kim B. "Commodity Report 2008: Cobalt" (PDF). United States Geological Survey. 6 Mart 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Ekim 2008.

















