Kloroplatinik asit
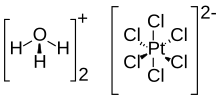 | |
 | |
 | |
| Adlandırmalar | |
|---|---|
Dihidronyum hekzakloroplatinat(2-) | |
Diğer adlar Hekzakloroplatinik asit | |
| Tanımlayıcılar | |
CAS numarası | |
3D model (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.037.267 |
| EC Numarası |
|
PubChem CID | |
| RTECS numarası |
|
CompTox Bilgi Panosu (EPA) | |
| |
| Özellikler | |
| Molekül formülü | H6Cl6O2Pt |
| Molekül kütlesi | 409.81 g/mol |
| Görünüm | Kırmızımsı kahverengi katı |
| Yoğunluk | 2.431 g/cm3 |
| Erime noktası | 60 °C (140 °F) |
| Kaynama noktası | ayrışır |
| Çözünürlük (su içinde) | Son derece çözünür |
| Tehlikeler | |
| İş sağlığı ve güvenliği (OHS/OSH): | |
| Ana tehlikeler | Toksik, aşındırıcı |
| GHS etiketleme sistemi: | |
| R-ibareleri | R25, R34, R43 |
| NFPA 704 (yangın karosu) | |
| Aksi belirtilmediği sürece madde verileri, Standart sıcaklık ve basınç koşullarında belirtilir (25 °C [77 °F], 100 kPa). | |
Kloroplatinik asit (hekzakloroplatinik asit olarak da bilinir), [H3O]2[PtCl6](H2O)x (0≤x≤6) formülüne sahip bir inorganik bileşiktir. Kırmızı bir katı, genellikle sulu bir çözelti olarak önemli bir platin kaynağıdır. Genellikle kısaca H2PtCl6 olarak yazılsa da, hekzakloroplatinat anyonunun (PtCl62-) hidronyum (H3O+) tuzudur.[1][2][3] Hekzakloroplatinik asit oldukça higroskopiktir.
Üretim

Hekzakloroplatinik asit, çeşitli yöntemlerle üretilebilir. Bu yöntemlerden en yaygın olanı, platinin kral suyunda çözülmesidir. Diğer yöntemler arasında, platin partiküllerinin sulu bir süspansiyonunun klor gazına veya elektroliz yoluyla maruz bırakılması yer alır.
Kral suyu yolu ile üretildiğinde, hekzakloroplatinik asidin aşağıdaki denklemden kaynaklandığı düşünülmektedir:[4][5]
Pt + 4 HNO3 + 6 HCl → H2PtCl6 + 4 NO2 + 4 H2O
Ortaya çıkan turuncu/kırmızı çözelti, kahverengimsi kırmızı kristaller üretmek için buharlaştırılabilir. Bazı yazarlar, bu yöntem kullanılarak üretilen hekzakloroplatinik asidin nitrosonyum hekzakloroplatinat ile kontamine olduğunu ileri sürmektedir. Daha yeni literatür, durumun böyle olmadığını ve nitrik asit uzaklaştırıldıktan sonra, bu yöntemle hazırlanan örneklerin saptanabilir azot içermediğini gösterir.
Alternatif yöntemler araştırılmış ve tanımlanmıştır, genellikle azot kontaminasyonunun önlenmesi ile motive edilmiştir.[6]
Reaksiyonlar
Isıtıldığında, hekzakloroplatinik asit platin(IV) klorüre ayrışır.[1]
- H3O)2PtCl6·nH2O → PtCl4 + 2 HCl + (n + 2) H2O
Uygulamalar
Potasyum tayini
Ayrıca bakınız: Potasyum hekzakloroplatinat
Kloroplatinik asit, potasyumun kantitatif analizi için popüler hale getirildi. Potasyum çözeltiden seçici olarak potasyum hekzakloroplatinat olarak çökeltilir. Belirlemeler, fazla platinat iyonu olan %85 (h/h) alkol çözeltilerinde yapıldı ve çökelen ürün tartıldı. Potasyum %0.02 ila %0.2 (m/v) oranında seyreltik olarak çözeltiler için tespit edilebilir.[7]
Potasyum tayini için bu yöntem, daha önce kullanılan sodyum kobaltinitrit yöntemine kıyasla avantajlıdır, çünkü tek bir çökeltme reaksiyonu gerektirmiştir.[7] Çöken ürünlerin gravimetrik analizi, iyon seçici elektrotlar, alev fotometrisi, ICP-AES veya ICP-MS gibi modern enstrümantal analiz yöntemleri ile desteklenmiştir.
Platinin saflaştırılması
Ayrıca bakınız: Amonyum hekzakloroplatinat
Amonyum klorür gibi bir amonyum tuzu ile işlemden sonra, kloroplatinik asit bir katı olarak çöken amonyum hekzakloroplatinata dönüşür.[4] Bir hidrojen atmosferinde ısıtıldıktan sonra amonyum tuzu elementer platine dönüşür. Platin genellikle cevherlerden izole edilir ya da artıklardan geri dönüştürülür.[8]
Kataliz
Birçok platin bileşiği gibi, kloroplatinik asit de hidrojenasyon ve ilgili reaksiyonlar için bir katalizördür (veya ön-katalizördür). İlk olarak John Speier ve Dow Corning'in meslektaşları tarafından bildirildiği gibi, olefinlere hidrosilanların ilavesini, yani hidrosililasyonu katalize eder. Erken gösterim reaksiyonlarında pentenlerle triklorosilanın (SiHCl3) izopropanol çözeltileri kullanıldı. Alkenlere silan eklenmesi ile ilgili önceki çalışmalar, verimsiz radikal reaksiyonlar gerektiriyordu.[9][10] Karstedt katalizörünün yanı sıra, Speier'in katalizörü hidrosililasyon için yaygın kullanıma sahiptir, ana dezavantaj katalizörün yumuşak özellikleridir.[11]
Genel olarak kloroplatinik asidin gerçek katalizörün bir öncüsü olduğu kabul edilir. Kolloidal platin veya sıfır değerlikli kompleksler için olası bir rol de dikkate alınmıştır.[12]
İlgili bileşikler
Kral suyundan hazırlanan kloroplatinik asidin nitrosonyum hekzakloroplatinat, (NO)2PtCl6 içerdiği önerilmektedir. Nitrosonyum hekzakloroplatinat, nitrosil klorür (NOCl) ve platin metalinin reaksiyonu ile elde edilir.[13] Nitrosonyum hekzakloroplatinatın su ve hidroklorik asit ile kuvvetli reaksiyona girdiği ve kral suyu ile hazırlanan kloroplatinik asidin nitrosonyum hekzakloroplatinat ile kontaminasyonu mümkün olmadığı bulunmuştur.
Kaynakça
- ^ a b Schweizer, A. E.; Kerr, G. T. (1978). "Thermal Decomposition of Hexachloroplatinic Acid". Inorg. Chem. 17 (8): 2326–2327. doi:10.1021/ic50186a067.
- ^ Holleman; Wiberg (2001). Inorganic Chemistry (First ed.). New York: Academic Press. ISBN 0-12-352651-5.
- ^ Greenwood, N. N.; Earnshaw, A. (1997). Chemistry of the Elements (Second ed.). New York: Elsevier Butterworth-Heinemann. ISBN 978-0-7506-3365-9.
- ^ a b Kauffman, George B. (1967). "Ammonium Hexachloroplatinate(IV)". Inorganic Syntheses. 9: 182–185. doi:10.1002/9780470132401.ch51. ISBN 9780470132401.
- ^ Grube, H. (1963). "Hexachloroplatinic(IV) Acid". In Brauer, G. (ed.). Handbook of Preparative Inorganic Chemistry. 2 (2nd ed.). New York: Academic Press. p. 1569.
- ^ Rudnick, Paul; Cooke, R. D. (1917). "The Preparation of Hydrochloroplatinic Acid by Means of Hydrogen Peroxide". J. Am. Chem. Soc. 39 (4): 633–635. doi:10.1021/ja02249a011.
- ^ a b Smith, G. Frederick; Gring, J. L. (1933). "The Separation and Determination of the Alkali Metals Using Perchloric Acid. V. Perchloric Acid and Chloroplatinic Acid in the Determination of Small Amounts of Potassium in the Presence of Large Amounts of Sodium". J. Am. Chem. Soc. 55 (10): 3957–3961. doi:10.1021/ja01337a007.
- ^ Cotton, S. A. (1997). Chemistry of Precious Metals. London: Chapman and Hall. ISBN 0-7514-0413-6.
- ^ Speier, J. L.; Webster, J. A.; Barnes, G. H. (1957). "The Addition of Silicon Hydrides to Olefinic Double Bonds. Part II. The Use of Group VIII Metal Catalysts". J. Am. Chem. Soc. 79 (4): 974–979. doi:10.1021/ja01561a054.
- ^ Saam, John C.; Speier, John L. (1958). "The Addition of Silicon Hydrides to Olefinic Double Bonds. Part III. The Addition to Non-terminal Olefins in the Presence of Chloroplatinic Acid". J. Am. Chem. Soc. 80 (15): 4104–4106. doi:10.1021/ja01548a073.
- ^ Sibi, Mukund P. (2001). "Hydrogen Hexachloroplatinate(IV)". Encyclopedia of Reagents for Organic Synthesis, 8 Volume Set. Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons. doi:10.1002/047084289X.rh038. ISBN 0471936235.
- ^ Lewis, L. N.; Sy, K. G.; Bryant, G. L.; Donahue, P. E. (1991). "Platinum-catalyzed hydrosilylation of alkynes". Organometallics. 10 (10): 3750–3759. doi:10.1021/om00056a055.
- ^ Moravek, R. T.; Kauffman, G. B.; Mahmood, T. (1967). "Nitrosyl Hexachloroplatinate(IV)". Inorganic Syntheses. 9: 217–220. doi:10.1002/9780470132555.ch63. ISBN 9780470132555.