Kimyasal bileşik, kimyasal bağlarla bir arada tutulan birden fazla kimyasal elementin atomlarını içeren birçok özdeş molekülden oluşan kimyasal maddedir. Dolayısıyla tek bir elementin atomlarından oluşan bir molekül bileşik değildir. Bir bileşik, diğer maddelerle etkileşimi içerebilen kimyasal reaksiyonla farklı bir maddeye dönüştürülebilir. Bu süreçte atomlar arasındaki bağlar kırılabilir ve/veya yeni bağlar oluşabilir.

Karboksilik asitler karboksil grubu olan organik asitlerdir, -C(=O)OH formülüne sahiptirler, bu genelde -COOH veya CO2H olarak da yazılır. Karboksilik asitler Bronsted asitleridir, yani proton vericileridir. Karboksilik asitlerin tuz ve anyonlarına karboksilat denir. Karboksilik asitler, esterlerle fonsiyonel grup izomeridirler. Karboksilik asitlerin en basit dizisi alkanoik asitlerdir, R-COOH formülüyle gösterilirler, R bir hidrojen atomu veya bir alkil grubuna karşılık gelir. Bileşiklerde birden fazla karboksilik asit grubu bulunabilir.

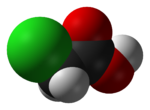
Hidroklorik asit, hidrojen ve klor elementlerinden oluşan, oda sıcaklığı ve normal basınçta gaz hâlinde olan hidrojen klorürün sulu çözeltisine verilen ad. Halk arasında tuz ruhu olarak da bilinir. 9. yüzyılda simyacı Câbir bin Hayyân tarafından keşfedildi ve sonrasında simya alanında kullanıldı. Sanayi Devrimi sırasında, sanayideki önemi keşfedilen asit, önce Leblanc işlemi, sonrasında Solvay işlemi ile sanayi alanında üretilmeye başladı. Hidroklorik asit, tarihte yeni kolaylıkların keşfinde önemli roller üstlendi. Günümüzde PVC'den demir-çeliğe, organik madde üretiminden gıda sektörüne kadar hemen hemen tüm alanlarda hidroklorik asit kullanılmaktadır.

Asetik asit veya etanoik asit CH3COOH formüllü bir organik asittir, sirkeye ekşi tadını ve keskin kokusunu vermesiyle bilinir. Bu yüzden halk arasında sirke ruhu veya sirke asidi şeklinde de adlandırılır. Karboksilik asitlerin en küçüklerindendir (en küçük olan formik asittir). Doğada karbonhidratların yükseltgenmesiyle oluşur. Sanayide asetik asit hem biyolojik yolla hem de sentetik yolla imal edilir. Tuz ve esterine asetat denir. Suda tamamen çözünür.
Nitrik asit, HNO3 kimyasal formülüne sahip oldukça aşındırıcı bir inorganik asittir. Kezzap olarak da bilinir. Saf hâldeki bileşik renksizdir. Ancak uzun süre bekleyen eski asitler azot oksitleri ve suya ayrışması nedeniyle sarı renge dönebilme özelliğindedirler. Piyasada bulunan nitrik asitlerin çoğu % 68'lik bir konsantrasyona sahiptir. Çözelti, %86'dan fazla HNO3 içerdiğinde, dumanlı nitrik asit olarak adlandırılır. Mevcut azot dioksit miktarına bağlı olarak, dumanlı nitrik asit ayrıca %86’nın üzerindeki konsantrasyonlarda kırmızı dumanlı nitrik asit veya %95’in üzerindeki konsantrasyonlarda beyaz dumanlı nitrik asit olarak tanımlanır.

Klorik asit (HClO3), klorun bir oksoasiti ve klorat tuzlarının formal öncülüdür. Güçlü bir asit (pKa ≈1) ve oksitleyici ajandır.

Amonyum klorür ya da daha çok bilinen adıyla Nişadır, formülü NH4Cl olan bir kimyasal bileşiktir. Suda yüksek oranda çözünen, beyaz kristallere sahip bir tuzdur. Amonyum klorür çözeltileri hafif asidiktir. Doğada mineral halde bazı volkan bacalarının etrafında bulunan haline sal amonyak denir. Bazı tür meyan ballarında bir aroma maddesi olarak kullanılır. Nişadır, hidroklorik asit ve amonyak arasında gerçekleşen reaksiyonla sonucu oluşur.

MeOAc, asetik asit metil esteri ya da metil etanoat olarak da bilinen Metil asetat, formülü CH3COOCH3 olan karboksilli bir esterdir. Karakteristik olarak, bazı tutkallar ve oje çıkarıcıların hoş kokusunu anımsatan yanıcı bir sıvıdır. Metil asetat, zayıf polar ve lipofilik özellikte olduğundan bazen bir solvent olarak kullanılmaktadır. Ancak yakın akrabası olan etil asetat daha az toksik ve suda daha az çözündüğünden dolayı çok daha yaygın kullanılan bir çözücüdür. Metil asetat, oda sıcaklığındaki su içerisinde %25 kadar bir çözünürlüğe sahiptir. Yüksek sıcaklıktaki suda, çözünürlüğü çok daha yüksektir. Metil asetat kuvvetli sulu bazlar ya da sulu asitlerin mevcudiyetinde kararlı değildir.

İyot monoklorür ICl formülü ile gösterilen bir interhalojen bileşiktir. Oda sıcaklığına yakın eriyen kırmızı-kahverengi renge sahip bir kimyasal bileşiktir. İyot ve klorun elektronegatifliği arasındaki fark nedeniyle, ICl oldukça kutupsaldır ve I+ kaynağı olarak davranır.

Kloroplatinik asit (hekzakloroplatinik asit olarak da bilinir), [H3O]2[PtCl6](H2O)x (0≤x≤6) formülüne sahip bir inorganik bileşiktir. Kırmızı bir katı, genellikle sulu bir çözelti olarak önemli bir platin kaynağıdır. Genellikle kısaca H2PtCl6 olarak yazılsa da, hekzakloroplatinat anyonunun (PtCl62-) hidronyum (H3O+) tuzudur. Hekzakloroplatinik asit oldukça higroskopiktir.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.

4-Nitroanilin, p-nitroanilin veya 1-amino-4-nitrobenzen C6H6N2O2 formülüne sahip organik bir bileşiktir. Bir amino grubunun bir nitro grubuna tam karşısında para konumunda olduğu, bir benzen halkasından oluşan organik kimyasal bileşiktir. Bu kimyasal madde genellikle boyaların, antioksidanların, ilaçların, benzinin, yakıt artığı önleyicilerinin, kümes hayvanı ilaçlarının sentezinde bir ara madde olarak ve bir korozyon önleyici olarak kullanılır.

Kimyasal reaktörler bir kimyasal reaksiyonun gerçekleştirildiği proses ekipmanlarıdır. Kimya mühendisliğinde proses tasarımı ve analizinde sık kullanılan klasik bir ünite prosesidir. Bir kimyasal reaktörün tasarımı, kimya mühendisliğinin birden fazla unsurunun kullanılmasını gerektirir. Reaktörler proseste ham maddelerin ürünlere dönüştüğü oldukça temel bir ekipman olduğundan proses tasarımı açısından büyük önem arz eder. Kimya mühendisleri bir reaksiyonun net bugünkü değerini en üst düzeye çıkarmak için reaktörler tasarlar. Tasarımcılar satın alma ve işletme maliyetini en düşük seviyelerde tutarken bir yandan da üretilen ürün miktarını en yüksek seviyede tutmak için reaksiyonun ürünler yönünde mümkün olan en yüksek verimle devamlılığını sağlarlar. Enerji girişi, enerji çıkışı, ham madde maliyetleri, işçilik vb. işletme giderlerine örnek olarak verilebilir. Isıtma, soğutma, basıncı artırmak için pompalama, sürtünmeden kaynaklı basınç düşüşü ve çöktürme gibi durumlar da enerji değişimlerine birer örnektir.

Bir Grignard reaktifi veya Grignard bileşiği, X'in bir halojen ve R'nin normalde bir alkil veya aril olduğu organik bir grup olduğu genel formül R−Mg−X'e sahip kimyasal bir bileşiktir. İki tipik örnek, metilmagnezyum klorür Cl−Mg−CH
3 ve fenilmagnezyum bromür (C
6H
5)−Mg−Br'dir. Organomagnezyum bileşiklerinin bir alt sınıfıdır.

Klor triflorür, formülü ClF3 olan interhalojen bir bileşiktir. Zehirli, aşındırıcı ve aşırı reaktiftir. Gaz hâlindeyken renksizken sıvı hâlindeyken solgun yeşilimsi sarı renktedir. Yarı iletken sanayiinde, nükleer yakıtların yeniden işlenmesinde, roket itici yakıtlarında ve diğer endüstriyel alanlarda kullanılır. Benzen, toluen, eter, alkol, asetik asit, hekzan gibi çözücüler ile reaksiyona girer. Karbon tetraklorürde çözünür ancak yüksek konsantrasyonlarda patlayıcı olabilir.
Bromoasetik asit, CH2BrCO2H formülüne sahip kimyasal bileşiktir. Bu renksiz katı, nispeten güçlü bir alkilasyon reaktifidir. Bromoasetik asit ve esterleri, organik sentezde örneğin farmasötik kimyada yaygın olarak kullanılan yapı taşlarıdır.

Triflorometansülfonik asit, (TFMS, TFSA, HOTf veya TfOH) veya kısaca triflik asit, CF3SO3H kimyasal formülüne sahip bir sülfonik asittir. Bilinen en güçlü asitlerden biridir. Triflik asit esas olarak araştırmalarda esterleşme için bir katalizör olarak kullanılır. Higroskopik, renksiz, biraz viskoz bir sıvıdır ve polar çözücülerde çözünür.

Trikloroasetik asit, metil grubundaki üç hidrojen atomunun tamamının klor atomları ile değiştirildiği bir asetik asit analoğudur. Trikloroasetik asitin tuzları ve esterlerine trikloroasetatlar denir.

Fosforil klorür, POCl
3 formülüne sahip bir sıvıdır. Nemli havada hidrolize olup fosforik asit ve hidrojen klorür dumanı açığa çıkarır. Endüstriyel olarak büyük ölçekte fosfor triklorür ve oksijen veya fosfor pentoksitten üretilir. Esas olarak fosfat esterleri yapmak için kullanılır.
Çinko klorür, ZnCl2·nH2O formülüne sahip, n değeri 0 ila 4,5 arasında değişen hidratlar oluşturan inorganik bir kimyasal bileşiktir. Susuz çinko klorür ve hidratları renksiz veya beyaz kristal katılardır ve suda oldukça çözünür. Beş çinko klorür hidratının yanı sıra dört susuz çinko klorür formu bilinmektedir. Çinko klorürün tüm formları nem çeker. Çinko klorür tekstil işlemede, metalurjik akılarda ve kimyasal sentezde geniş uygulama alanı bulur.