
Rubidyum, Rb sembolü ile gösterilen, 37 atom numarasına sahip alkali metaller grubundan bir kimyasal element. 1861 yılında Gustav Kirchhoff ve Robert Bunsen tarafından Almanya'da keşfedilmiştir. Kimyasal açıdan potasyum ve sezyumun özelliklerine benzer özellikler gösterir ama potasyuma oranla çok ender bulunur. Oda sıcaklığında gümüşi beyaz renkli, yumuşak ve parlak bir katıdır. Kuru havada bile çok çabuk yükseltgenir, bu yüzden açık havada saklanamaz. Suyu şiddetle ayrıştırır ve ortaya çıkan hidrojeni tutuşturur.

Oksijen atom numarası 8 olan ve O harfi ile simgelenen kimyasal elementtir. Oksijen ismi Yunanca ὀξύς (oxis - "asit", tam anlamıyla "keskin", asitlerin acı tadı kastedilir) ve -γενής (-genēs) ("üretici", tam anlamıyla "sebep olan şey") köklerinden gelmektedir, çünkü isimlendirildiği zamanlarda tüm asitlerin oksijen içerikli olduğu sanılırdı. Standart şartlar altında, elementin iki atomu bağlanarak çok soluk mavi renkte, kokusuz, tatsız, diatomik yapıdaki, O2 formülüne sahip dioksijen gazını oluşturur.

Tuz, kimyada, bir asitle bir bazın tepkimeye girmesi neticesinde meydana gelen maddedir. Tuz, asitteki eksi yüklü iyonla (anyon) bazdaki artı yüklü iyondan (katyon) meydana gelir. Asitle baz arasındaki nötralleşme tepkimesi esnasında tuz ve su açığa çıkar. Erimiş tuz veya çözelti halindeki tuzların çoğu eksi ile artı yüklü iyonlarına ayrışır ve elektriği iletir. Tuz adı ayrıca sofra tuzu veya sodyum klorür (NaCl) için de kullanılır.

Sezyum, atom numarası 55 olan, alkali metaller grubuna ait bir kimyasal element. Element oda sıcaklığında katı olsa da 28 °C'de erimektedir. Sezyuma doğada ender rastlanır. Gümüşümsü altın renklidir ve metalik yapıdadır. Element, Robert Wilhelm Bunsen ve Gustav Kirchoff tarafından 1860 yılında mineral suyunda keşfedildi.

Hidroklorik asit, hidrojen ve klor elementlerinden oluşan, oda sıcaklığı ve normal basınçta gaz hâlinde olan hidrojen klorürün sulu çözeltisine verilen ad. Halk arasında tuz ruhu olarak da bilinir. 9. yüzyılda simyacı Câbir bin Hayyân tarafından keşfedildi ve sonrasında simya alanında kullanıldı. Sanayi Devrimi sırasında, sanayideki önemi keşfedilen asit, önce Leblanc işlemi, sonrasında Solvay işlemi ile sanayi alanında üretilmeye başladı. Hidroklorik asit, tarihte yeni kolaylıkların keşfinde önemli roller üstlendi. Günümüzde PVC'den demir-çeliğe, organik madde üretiminden gıda sektörüne kadar hemen hemen tüm alanlarda hidroklorik asit kullanılmaktadır.

Sülfürik(VI) asit ya da halk arasında bilinen ismi ile zaç yağı, H2SO4, güçlü bir mineral asididir. Olası kâşifi 8. yüzyıl simyacısı Cabir bin Hayyan tarafından yenime uğratıcı, renksiz ve yoğunluğu yüksek sıvı olarak tanımlanmıştır. Suda her konsantrasyonda çözünebilir. Büyük ölçüde korozif oluşu, güçlü asidik yapısından ve dehidrasyon özelliğinden kaynaklanmaktadır.

Klorik asit (HClO3), klorun bir oksoasiti ve klorat tuzlarının formal öncülüdür. Güçlü bir asit (pKa ≈1) ve oksitleyici ajandır.
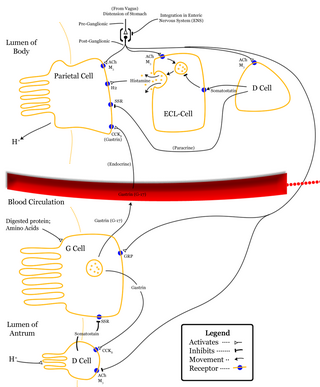
Gastrik asit, mide öz suyunda yer alan bir tür sindirim asididir. Asit, midenin iç yüzeyinde yer alan hücreler tarafından üretilmektedir. Asit, tam bir formüle sahip olmamakla beraber, hidroklorik asit (HCl), potasyum klorit (KCl) ve sofra tuzu (NaCl) içermektedir. Asidin pH değeri, 1 ve 2 arasında olup, normal şartlarda insanlar için oldukça zararlıdır. Gastrik asidin fazla üretildiği zamanlarda, midede yaralar, gastritis ve Gastrik ülser oluşmaktadır. Aynı şekilde bu asidin yetersiz kaldığı zamanlarda da sindirim sorunları yaşanmaktadır. Asit, herhangi bir gıdayı sindirirken, aşağıdaki kimyasal tepkime meydana gelmektedir.
- HCl + NaHCO3 → NaCl + H2CO3
Etan, C2H6 formülüne sahip bir bileşiktir. Alkanların ikinci en küçük molekülü olan etan, normal sıcaklık ve basınçta kokusuz ve renksiz bir gazdır. Etan, doğalgazda metandan sonra en fazla bulunan ikinci gazdır.

Sodyum klorat NaClO3 kimyasal formülüne sahip bir inorganik bileşiktir. Suda kolayca çözünür, beyaz kristal bir tozdur. Higroskopiktir. Sodyum klorat 300 °C’nin üzerinde ayrışarak oksijen ve sodyum klorür ortaya çıkar. Özellikle, çok parlak kâğıt imal etmek için ağartma hamurundaki uygulamalara yönelik olarak yılda birkaç yüz milyon ton üretilmektedir.

Yükseltgen madde bir yükseltgenme-indirgenme (redoks) reaksiyonunda başka bir türden bir elektron alan element ya da bileşiktir. Yükseltgen maddelerin elektron kazandıklarından dolayı indirgendikleri söylenebilir.

Silisyum dioksit veya silika, oksijen ve silisyum içeren kimyasal bileşik. Kimyasal formülü SiO2'dir. 16. yüzyıldan beri bilinmektedir. Cam, beton, fayans, porselen gibi birçok maddede kullanılmaktadır. SiO2, daha çok herhangi bir malzeme yerine, kristalin formları (polimorf) şeklinde bulunmaktadır. Kuvars, topaz ve ametist gibi 17 farklı kristal formu vardır.

Sodyum klorit (NaClO2) kâğıt üretiminde ve dezenfektan olarak kullanılan kimyasal bir bileşiktir.

Kloril florür ClO2F formüllü bileşik. Sıklıkla klor florürlerinin oksijen kaynakları ile olan reaksiyonlarında yan ürün olarak görülür. Klorik asitin asil florürüdür.

Kloröz asit, HClO2 formülüne sahip bir inorganik bileşiktir. Zayıf bir asittir. Klor, bu asitte +3 oksidasyon durumuna sahiptir. Saf madde dengesiz, hipokloröz aside (Cl oksidasyon hali + 1) ve klorik aside (Cl oksidasyon hali + 5) orantısızdır:

Tellüröz asit, H2TeO3 formülüne sahip bir inorganik bileşiktir. Tellürün (IV) oksoasididir. Bileşik iyi karakterize edilmemiştir. Formülünü yazmanın alternatif bir yolu (HO)2TeO'dur. Prensip olarak, tellüröz asit, tellür dioksitin su ile, yani hidrolizle işlenmesiyle oluşacaktır. İlgili konjugat bazı, potasyum hidrojen tellürit (KHTeO3) gibi çeşitli tuzlar formunda iyi bilinmektedir.
Titanik asit, genel formül [TiOx(OH)4−2x]n ile titanyum, hidrojen ve oksijen elementlerinin kimyasal bileşiklerinin bir ailesi için genel bir isimdir. Esas olarak eski literatürde çeşitli basit titanik asitler talep edilmiştir. Bu malzemeler için kristalografik ve az spektroskopik destek yoktur. Brauer'in El Kitabı da dahil olmak üzere bazı eski literatür TiO2'den titanik asit olarak söz eder.
- Metatitanik asit (H2TiO3)
- Ortotitanik asit (H4TiO4) "TiO2·2.16H2O" altında beyaz tuz benzeri bir toz olarak tarif edilir.
- Peroksotitanik asit (Ti(OH)3O2H) ayrıca sülfürik asit içindeki titanyum dioksitin hidrojen peroksit ile işlenmesi sonucu da tarif edilmiştir. Elde edilen sarı katı O2 kaybı ile ayrışır.
- Pertitanik asit (H2TiO4)
- Pertitanik asit (TiO(H2O2)2+)

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.
Klor, günümüzde suyun dezenfeksiyonu amacıyla en sık kullanılan kimyasal maddedir. Klor suda genellikle elemental klor (Cl2, Klor gazı), Kalsiyum Hipoklorit (Ca(ClO)2) veya sodyum hipoklorit solüsyonu (NaClO, çamaşır suyu) şeklinde uygulanmaktadır.Ayrıca klorun Türkiye'de en sık kullanılan formu, sodyum hipoklorittir. Bu uygulamaların her biri ise suda serbest klor oluşumuna neden olmaktadır.Klor basınçlı tanlarda sıvılaştırılmış gaz halinde taşınır ve depolanır.Klor doğru dozajda yapıldığında mikroorganizmaların membranına etki ederek,buradaki proteinlerin yapısında bulunan aminoasitlerden kloraminler meydana getirmek amacıyla mikroorganizmaların çoğalma ve gelişmelerini önler.Kuvvetli oksidan etkiye sahip ve korozyona yol açan bir dezenfektandır.Klorun doz artışıyla birlikte korozif etkisi de belirgin olarak artmaktadır. Klor ile dezenfeksiyonun çevresel etkileri şöyledir;
- Kalsiyum hipoklorür yangın ve patlama tehlikelerine neden olabilir.
- ClO2 in ortamda, az miktarda klorlu maddeler oluşturduğu fakat bunun yanı sıra zehirli bir madde olan kloriti meydana getirdiği gözlenmiştir.Klorit ise kanda bulunan hemoglobini okside ederek vücuttaki görevini yapamaz duruma getirmektedir.
- Suya yeterli miktarda klor ilave edilmelidir. Daha fazla kullanılması hâlinde suyun lezzet ve kokusunu bozar.Bu da istenmeyen bir durumdur.
- Klor gazı çok zehirli ve tahriş edici bir gazdır. Bilinçli olarak kullanmak gerekir.
- Korozif etkisinden dolayı metallerin ve boyaların şeklini,yapısını bozabilir.Suların taşınmasını zorlaştırabilir.

Baryum klorür, BaCl2 formüllü inorganik bir bileşik'tir. Bu bileşik baryum'un suda-çözünen en yaygın tuzlarından biridir. Diğer baryum tuzlarının çoğu gibi, baryum klorür beyaz toz halinde ve zehirlidir. Alevde sarı-yeşil renk verir. Ayrıca higroskopiktir, ilk önce dihidrat BaCl2(H2O)2' ye dönüşür.



















