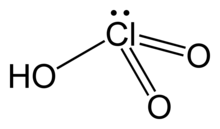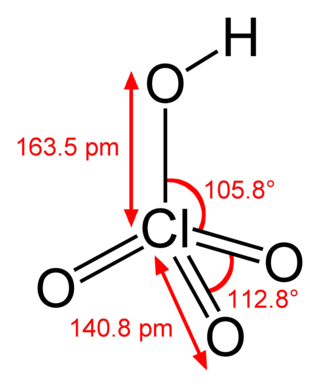
Perklorik asit, HClO4, suda çözünebilen renksiz bir sıvı olan bir klor oksoasididir. Sülfürik asit ya da nitrik asit ile kıyaslanabilecek kadar güçlü bir asittir. Perklorik asit bir süper asittir ancak en güçlü Brønsted-Lowry asidi değildir (en güçlüsü HSbF6 ya da floroantimonik asittir). Asidin pKa'sı −7'dir.

Perklorat, ClO4− formülüyle göserilen bir kimyasal kök. Bileşiklerinde daima bir adet elektron alır. Perkloratlar perklorik asitin tuzlarıdır. Perkloratlar özellikle tıpta tiroid bezleri tedavisinde kullanılmaktadır. Bunlarla beraber, hava yastığı ve havai fişek gibi bazı ürünlerde perkloratlara rastlanmaktadır.

Sodyum perklorat formülü NaClO4 olan bir kimyasal bileşiktir. Perklorik asitin sodyum tuzu olan bu bileşik diğer perkloratlar gibi kuvvetli bir oksitleyicidir. Sodyum perkloratın çözünürlüğü diğer perklorat tuzları içinde en yüksek olanıdır. Beyaz kristallerden oluşan ve higroskopik özellikte olan sodyum perklorat suda ve alkolde oldukça çok çözünür. Genellikle monohidrat form halinde bulunur ve rombik bir kristal yapısına sahiptir. Standart oluşum entalpisi −382.75 kJ mol−1 dir.
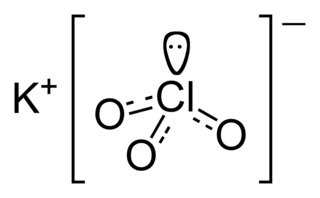
Potasyum klorat formülü KClO3 olan bir kimyasal bileşiktir. Klorik asitin potasyum tuzu olan bu bileşik diğer kloratlar gibi kuvvetli bir oksitleyicidir.

Baryum klorat formülü Ba(ClO3)2 olanbeyaz kristal yapıya sahip bir kimyasal bileşiktir. Tüm çözünür baryum bileşikleri gibi tahriş edici ve zehirlidir. Klorik asitin baryum tuzu olan bu bileşik diğer kloratlar gibi kuvvetli bir oksitleyicidir. Bazen piroteknikte yeşil bir renk üretmek için kullanılır. Klorik asit üretiminde de kullanılır.

Sodyum klorat NaClO3 kimyasal formülüne sahip bir inorganik bileşiktir. Suda kolayca çözünür, beyaz kristal bir tozdur. Higroskopiktir. Sodyum klorat 300 °C’nin üzerinde ayrışarak oksijen ve sodyum klorür ortaya çıkar. Özellikle, çok parlak kâğıt imal etmek için ağartma hamurundaki uygulamalara yönelik olarak yılda birkaç yüz milyon ton üretilmektedir.

Baryum perklorat formülü Ba(ClO4)2 olan bir kimyasal bileşiktir. Perklorik asitin baryum tuzu olan bu bileşik diğer perkloratlar gibi kuvvetli bir oksitleyicidir. Piroteknik endüstrisinde kullanılır.
Magnezyum klorat formülü Mg(ClO3)2 olan bir kimyasal bileşiktir. Klorik asitin magnezyum tuzu olan bu bileşik diğer kloratlar gibi kuvvetli bir oksitleyicidir.
Kalsiyum klorat kimyasal formülü Ca(ClO3)2 olan bir bileşiktir. Klorik asitin kalsiyum tuzudur. Potasyum klorat gibi, kuvvetli bir oksitleyici olan bu bileşik, piroteknik formülasyonlarda kullanılabilir. Kalsiyum klorat kuvvetle ısıtıldığında ya da organik madde gibi indirgeyici maddelerle karıştırıldığında patlayabilir.

Kloril florür ClO2F formüllü bileşik. Sıklıkla klor florürlerinin oksijen kaynakları ile olan reaksiyonlarında yan ürün olarak görülür. Klorik asitin asil florürüdür.

İyodik asit, HIO3, beyaz veya kirli beyaz bir katı madde olarak elde edilebilir. Suda çok iyi çözünür, ancak klorik asit veya bromik asidin aksine saf halde bulunur. İyodik asit +5 oksidasyon durumunda iyot içerir ve halojenlerin saf halde en stabil okso-asitlerinden biridir. İyot asidi dikkatle ısıtıldığında pentoksit iyice dehidre olur. Daha sonraki ısıtmada, iyot pentoksit ayrıca iyot, oksijen ve düşük iyot oksitleri karışımı vererek ayrışır.

Kloröz asit, HClO2 formülüne sahip bir inorganik bileşiktir. Zayıf bir asittir. Klor, bu asitte +3 oksidasyon durumuna sahiptir. Saf madde dengesiz, hipokloröz aside (Cl oksidasyon hali + 1) ve klorik aside (Cl oksidasyon hali + 5) orantısızdır:

Arsenöz asit (veya arsenik oksit), H3AsO3 formülüne sahip bir inorganik bileşiktir. Sulu çözeltilerde meydana geldiği bilinmektedir, ancak bu gerçek As(OH)3'ün öneminden uzaklaşmasa da saf bir malzeme olarak izole edilmemiştir.
Hiponitröz asit, H2N2O2 veya HON=NOH formülüne sahip kimyasal bir bileşiktir. Bir nitramid, H2N−NO2 izomeridir.
Permanganik asit, HMnO4 formülüne sahip bir inorganik bileşiktir. Bu güçlü oksoasit, dihidrat olarak izole edilmiştir. Permanganat tuzlarının konjugat asididir. Çok az sayıda yayın konusu olup, karakterizasyonu ve kullanımları çok sınırlıdır.

Tellüröz asit, H2TeO3 formülüne sahip bir inorganik bileşiktir. Tellürün (IV) oksoasididir. Bileşik iyi karakterize edilmemiştir. Formülünü yazmanın alternatif bir yolu (HO)2TeO'dur. Prensip olarak, tellüröz asit, tellür dioksitin su ile, yani hidrolizle işlenmesiyle oluşacaktır. İlgili konjugat bazı, potasyum hidrojen tellürit (KHTeO3) gibi çeşitli tuzlar formunda iyi bilinmektedir.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.

Hidrojen bromat olarak da bilinen bromik asit, HBrO3 moleküler formülüne sahip bir oksoasittir. Sadece sulu çözelti içinde bulunur. Broma ayrışırken oda sıcaklığında sarıya dönen renksiz bir çözeltidir. Bromik asit ve bromatlar güçlü oksitleyici ajanlardır ve Belousov-Zhabotinsky reaksiyonlarında yaygın bileşenlerdir. Belousov-Zhabotinsky reaksiyonları denge olmayan termodinamiğin klasik bir örneğidir.

Tellürik asit, Te(OH)6 formülüne sahip kimyasal bir bileşiktir. Sulu çözelti içinde devam eden oktahedral Te(OH)6 moleküllerinden oluşan beyaz bir katıdır. Rombohedral ve monoklinik olmak üzere iki formu vardır ve her ikisi de oktahedral Te(OH)6 molekülleri içerir. Tellürik asit, güçlü bazlara sahip tellürat tuzları ve zayıf bazlara sahip hidrojen tellürat tuzları veya sudaki tellüratların hidrolizi üzerine dibazik olan zayıf bir asittir.

Baryum klorür, BaCl2 formüllü inorganik bir bileşik'tir. Bu bileşik baryum'un suda-çözünen en yaygın tuzlarından biridir. Diğer baryum tuzlarının çoğu gibi, baryum klorür beyaz toz halinde ve zehirlidir. Alevde sarı-yeşil renk verir. Ayrıca higroskopiktir, ilk önce dihidrat BaCl2(H2O)2' ye dönüşür.