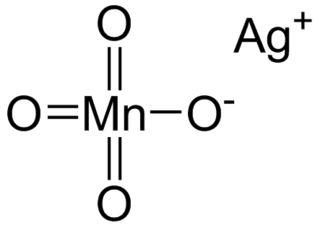Kloroform veya triklorometan, CHCl
3 formülüne sahip bir organik bileşiktir. Oda sıcaklığında kolay buharlaşan, hoş kokulu, renksiz, yanıcı olmayan ağır bir sıvıdır. Çözücü olarak sıkça kullanılır. PTFE (Teflon) ve bazı soğutucuların üretiminde kullanılmak için bol miktarlarda üretilir.

Kobalt kimyasal bir element'tir. Sembol'ü Co ve atom numarası 27'dir. Nikel gibi kobalt da, doğal meteorik demir alaşımlarında bulunan küçük birikintiler dışında, yer kabuğunda yalnızca kimyasal olarak birleşik formda bulunur. İndirgeyici eritme yoluyla üretilen serbest element sert, parlak, gümüş rengi bir metal'dir.
Astatin; simgesi At, atom numarası 85 olan radyoaktif bir elementtir. Yalnızca bazı ağır elementlerin bozunma ürünü olarak meydana gelir ve Dünya'nın yerkabuğunda doğal yollarla oluşan elementlerin en nadir olanıdır. En kararlı izotopu, 8,1 saatlik yarı ömre sahip astatin-210'dur. Kendi radyoaktivitesinin ürettiği ısı ile anında buharlaşmasından ötürü elementin saf bir örneği elde edilememiştir.
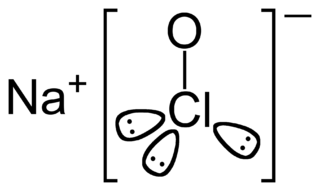
Sodyum hipoklorit, (NaClO) bir tür tuzdur. Günlük hayatta beyazlatıcı çamaşır sularında kullanılmaktadır. Oda koşullarındaki klor ile sabunlardaki sodyum hidroksit tepkimeye sokularak üretilmektedir.
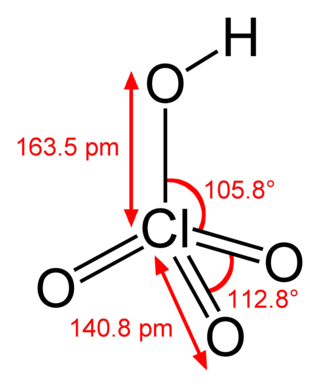
Perklorik asit, HClO4, suda çözünebilen renksiz bir sıvı olan bir klor oksoasididir. Sülfürik asit ya da nitrik asit ile kıyaslanabilecek kadar güçlü bir asittir. Perklorik asit bir süper asittir ancak en güçlü Brønsted-Lowry asidi değildir (en güçlüsü HSbF6 ya da floroantimonik asittir). Asidin pKa'sı −7'dir.

Sodyum perklorat formülü NaClO4 olan bir kimyasal bileşiktir. Perklorik asitin sodyum tuzu olan bu bileşik diğer perkloratlar gibi kuvvetli bir oksitleyicidir. Sodyum perkloratın çözünürlüğü diğer perklorat tuzları içinde en yüksek olanıdır. Beyaz kristallerden oluşan ve higroskopik özellikte olan sodyum perklorat suda ve alkolde oldukça çok çözünür. Genellikle monohidrat form halinde bulunur ve rombik bir kristal yapısına sahiptir. Standart oluşum entalpisi −382.75 kJ mol−1 dir.

Amonyum perklorat (AP) formülü NH4ClO4 olan bir kimyasal bileşiktir. Perklorik asitin amonyum tuzu olan bu bileşik diğer perkloratlar gibi kuvvetli bir oksitleyicidir. Kuvvetli oksitleyici oluşu, amonyum perkloratın başlıca kullanım alanınını katı itici yakıtlar olarak belirlemiştir. Amonyum perklorat aynı zamanda PEPCON endüstri felaketi ve Güney Afrika Havayolları 295 no’lu uçuş kazası gibi bir dizi kazadan da sorumludur.

Potasyum perklorat formülü KClO4 olan bir kimyasal bileşiktir. Diğer perkloratlar gibi, bu tuz da güçlü bir oksitleyici olup potansiyel olarak birçok organik maddeyle reaksiyona girer. Havai fişek, mühimmat kapsülleri ve primer patlayıcılarda yaygın bir oksitleyici olarak kullanılan katı ve renksiz kristallerden oluşan bu madde çeşitli şekilde itici yakıtlar, flaş bileşimleri, yıldızlar ve maytaplarda da kullanılmaktadır. Daha yüksek performanslı amonyum perklorat yerine çoğu kez ikame edilerek katı yakıtlı roket itici yakıtı olarak da kullanılmıştır. KClO4 alkali metal perkloratlar içerisinde en düşük çözünürlüğe sahiptir (25 °C'deki 100 ml. suda 1.5 gr.).

Baryum perklorat formülü Ba(ClO4)2 olan bir kimyasal bileşiktir. Perklorik asitin baryum tuzu olan bu bileşik diğer perkloratlar gibi kuvvetli bir oksitleyicidir. Piroteknik endüstrisinde kullanılır.

Richard Fred Heck, Amerikan kimyacı. 2010 yılı Nobel Kimya Ödülünü Japon kimyacılar Ei-ichi Negishi ve Suzuki Akira ile paylaşmaya layık görülmüştür. Bu ödülü kazanmasında organik molekül oluşturulmasında paladyumu katalizör olarak kullandığı çalışmalarının etkisi olmuştur.
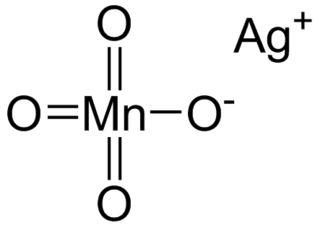
Gümüş permanganat kimyasal formülü AgMnO4 olan bir kimyasal bileşiktir. Gümüş permanganat monoklinik kristal sistemine ait mor renkli kristallere sahiptir. Isıtmayla ya da suyla karıştırıldığında parçalanır. Yüksek sıcaklıkta ısıtma patlamaya yol açabilir. Gümüş permanganat, gümüş nitrat ve potasyum permanganat arasındaki reaksiyonla elde edilebilir:
- AgNO3 + KMnO4 → AgMnO4 + KNO3

Ksenon tetroksit, kimyasal formülü XeO4 olan, ksenon ile oksijen elementlerinin reaksiyonuyla meydana gelen soy gaz bileşiğidir. Ksenon tetroksit, -35,9 °C sıcaklıkta kristal yapıda ve sarı renkli bir katı hâlde olup, daha sıcak ortamlarda ksenon ve oksijen (O2) elementlerine çözünmeye yatkındır.

İyot triklorür, iyot ve klordan oluşan bir interhalojen bileşiktir. Bu parlak sarı ve katı hâlde bir düzlemsel olarak mevcut olan dimer I2Cl6, iki köprü Cl atomlarına sahip Cl2I(μ-Cl)2ICl2 tir.
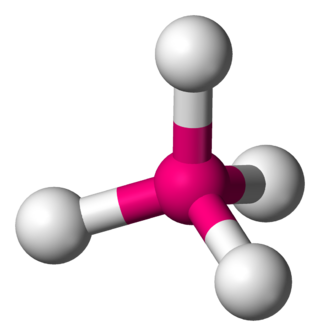
Dörtyüzlü veya tetrahedral molekül geometrisi, merkezi atomun, dört yüzlünün ortasında, dört köşede ise sübstitüentlerin yer aldığı molekül geometrisidir. Bağ açıları, dört sübstitüent aynı olduğunda (örn. metan CH4 ya da daha ağır analogları) cos−1 (-⅓) = 109,4712206 ...° ≈ 109.5° olur. Metan veya diğer simetrik yüzlü moleküller Td nokta grubuna aittir, ama dörtyüzlü moleküller genellikle düşük simetriye sahiptir. Tetrahedral moleküller kiral olabilir.

Gümüş iyodat (AgIO3), gümüş, iyot ve oksijenden oluşan ışığa duyarlı, beyaz bir kristaldir. Çoğu metal iyodürün aksine, suda neredeyse çözünmez.
Permanganik asit, HMnO4 formülüne sahip bir inorganik bileşiktir. Bu güçlü oksoasit, dihidrat olarak izole edilmiştir. Permanganat tuzlarının konjugat asididir. Çok az sayıda yayın konusu olup, karakterizasyonu ve kullanımları çok sınırlıdır.
Titanik asit, genel formül [TiOx(OH)4−2x]n ile titanyum, hidrojen ve oksijen elementlerinin kimyasal bileşiklerinin bir ailesi için genel bir isimdir. Esas olarak eski literatürde çeşitli basit titanik asitler talep edilmiştir. Bu malzemeler için kristalografik ve az spektroskopik destek yoktur. Brauer'in El Kitabı da dahil olmak üzere bazı eski literatür TiO2'den titanik asit olarak söz eder.
- Metatitanik asit (H2TiO3)
- Ortotitanik asit (H4TiO4) "TiO2·2.16H2O" altında beyaz tuz benzeri bir toz olarak tarif edilir.
- Peroksotitanik asit (Ti(OH)3O2H) ayrıca sülfürik asit içindeki titanyum dioksitin hidrojen peroksit ile işlenmesi sonucu da tarif edilmiştir. Elde edilen sarı katı O2 kaybı ile ayrışır.
- Pertitanik asit (H2TiO4)
- Pertitanik asit (TiO(H2O2)2+)
İnterhalojen, iki ya da daha fazla farklı halojen atomu içeren ve halojenler dışında herhangi bir başka element atomu içermeyen bileşiktir. Üç ya da daha fazla halojen içeren interhalojenin varlığına kein olarak rastlanmasa da, bazı kaynaklarda IFCl2 veya IF2Cl bileşiklerinin varlığından söz edilmektedir. Teorik çalışmalar ise BrClFn serisindeki bazı bileşiklerin neredeyse kararlı olduğunu gösterir.
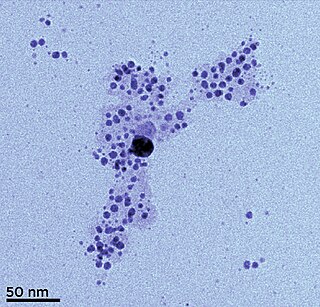
Gümüş nanoparçacıklar, boyutları 1 nm ile 100 nm arasında olan gümüş nanoparçacıklarıdır. Sıklıkla 'gümüş' olarak tanımlansa da bazıları, yüzeylerinin büyük gümüş atomlarına oranı nedeniyle büyük oranda gümüş oksitten oluşur. Eldeki uygulamaya bağlı olarak çok sayıda nanoparçacık şekli oluşturulabilir. Yaygın olarak kullanılan gümüş nanoparçacıklar küreseldir, ancak elmas, sekizgen ve ince tabakalar da yaygındır.

Klor triflorür, formülü ClF3 olan interhalojen bir bileşiktir. Zehirli, aşındırıcı ve aşırı reaktiftir. Gaz hâlindeyken renksizken sıvı hâlindeyken solgun yeşilimsi sarı renktedir. Yarı iletken sanayiinde, nükleer yakıtların yeniden işlenmesinde, roket itici yakıtlarında ve diğer endüstriyel alanlarda kullanılır. Benzen, toluen, eter, alkol, asetik asit, hekzan gibi çözücüler ile reaksiyona girer. Karbon tetraklorürde çözünür ancak yüksek konsantrasyonlarda patlayıcı olabilir.