Klavulanik asit
 | |
 | |
| Klinik verisi | |
|---|---|
| Telaffuz | /ˌklævjʊˈlænɪk/ |
| AHFS/Drugs.com | Uluslararası İlaç İsimleri |
| Gebelik kategorisi |
|
| Uygulama yolu | Oral, IV |
| ATC kodu |
|
| Hukuki durum | |
| Hukuki durum |
|
| Farmakokinetik veri | |
| Biyoyararlanım | "İyi absorbe edilir" |
| Metabolizma | Hepatik (yaygın) |
| Eliminasyon yarı ömrü | 1 saat |
| Boşaltım | Renal (%30-40) |
| Tanımlayıcılar | |
| |
| CAS Numarası | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| CompTox Bilgi Paneli (EPA) | |
| ECHA Bilgi Kartı | 100.055.500 |
| Kimyasal ve fiziksel veriler | |
| Formül | C8H9NO5 |
| Mol kütlesi | 199,162 g·mol−1 |
| 3D model (JSmol) | |
| |
| |
Klavulanik asit, mekanizma bazlı bir β-laktamaz inhibitörü olarak işlev gören bir β-laktam ilaçtır. Tek başına bir antibiyotik olarak etkili olmasa da penisilin grubu antibiyotiklerle kombine edildiğinde, β-laktamaz salgılayan bakterilerde antibiyotik direncinin üstesinden gelebilir, aksi takdirde β-laktamaz çoğu penisilini etkisiz hale getirir.
En yaygın preparatlarında, potasyum klavulanat (potasyum tuzu olarak klavulanik asit) ile birleştirilir:
- amoksisilin (ko-amoksiklav, ticari isimler Augmentin, Clavulin, Tyclav, Clavaseptin (veteriner), Clavamox (veteriner), Synulox (veteriner) ve diğerleri)
- tikarsilin (ko-tikarklav, ticari adı Timentin)
Klavulanik asidin patenti 1974 yılında alınmıştır.[1]
Tıbbi kullanımlar
Amoksisilin-klavulanik asit, sinüs enfeksiyonları ve piyelonefrit dahil olmak üzere idrar yolu enfeksiyonları dahil olmak üzere birçok enfeksiyon türü için ilk basamak tedavidir. Bunun nedeni kısmen, kemoterapötik antibiyotiklerle gram-pozitif bakterilere kıyasla kontrol altına alınması daha zor olan gram-negatif bakterilere karşı etkinliğidir.
Advers etkiler
Penisilinlerle birlikte klavulanik asit kullanımı, tedavi sırasında veya kısa bir süre sonra kolestatik sarılık ve akut hepatit insidansında artış ile ilişkilendirilmiştir. İlişkili sarılık genellikle kendi kendini sınırlar ve çok nadiren ölümcüldür.[2][3]
Birleşik Krallık İlaç Güvenliği Komitesi (CSM), amoksisilin/klavulanik asit preparatları gibi tedavilerin amoksisiline dirençli β-laktamaz üreten suşların neden olabileceği bakteriyel enfeksiyonlar için ayrılmasını ve tedavinin normalde 14 günü aşmamasını tavsiye etmektedir.
Alerjik reaksiyonlar bildirilmiştir.[4]
Kaynaklar
Bu isim, klavulanik asit üreten Streptomyces clavuligerus suşlarından türetilmiştir.[5][6]
Biyosentez

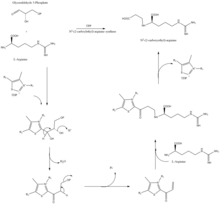
Klavulanik asidin β-laktam benzeri yapısı yapısal olarak penisiline benzer, ancak bu molekülün biyosentezi farklı bir biyokimyasal yol içerir. Klavulanik asit, Streptomyces clavuligerus bakterisi tarafından gliseraldehit 3-fosfat ve L-arjinin başlangıç maddeleri olarak kullanılarak üretilir.[7][8] Yolun ara maddelerinin her biri bilinmesine rağmen, tüm enzimatik reaksiyonlar için kesin mekanizma tam olarak anlaşılamamıştır.
Süreç temel olarak 3 enzim içerir: klavaminat sentaz, β-laktam sentetaz ve N2-(2-karboksietil)-L-arjinin (CEA) sentaz.[7] Klavaminat sentaz, demir ve α-keto-glutarata bağımlı hem olmayan bir oksijenazdır ve klavulanik asit gen kümesinin orf5'i tarafından kodlanır. Bu enzimin nasıl çalıştığına dair spesifik mekanizma tam olarak anlaşılamamıştır, ancak bu enzim klavulanik asidin genel sentezinde 3 adımı düzenler. Her 3 adım da katalitik, demir içeren reaksiyon merkezinin aynı bölgesinde gerçekleşir, ancak sırayla gerçekleşmez ve klavulanik asit yapısının farklı alanlarını etkiler.[9]
β-laktam sentetaz, klavulanik asit gen kümesinin orf3'ü tarafından kodlanan 54,5 kDa'luk bir proteindir ve asparajin sentaz - Sınıf B enzimlerine benzerlik gösterir. Bu enzimin β-laktam sentezlemek için nasıl çalıştığına dair kesin mekanizma kanıtlanmamıştır, ancak bir CEA sentaz ve ATP ile koordinasyon içinde gerçekleştiğine inanılmaktadır.[10]

CEA sentaz 60,9 kDA'lık bir proteindir ve klavulanik asit biyosentez gen kümesinde bulunan ilk gendir ve klavulanik asit gen kümesinin orf2'si tarafından kodlanır. Bu enzimin nasıl çalıştığına dair spesifik mekanizma halen araştırılmaktadır; ancak bu enzimin klavulanik asit biyosentezinin ilk adımı olan tiamin difosfat (TDP veya tiamin pirofosfat) varlığında gliseraldehit-3-fosfatı L-arginin ile birleştirme yeteneğine sahip olduğu bilinmektedir.[11]
Tarihçe
Klavulanik asit 1974-75 yıllarında Beecham ilaç şirketinde çalışan İngiliz bilim adamları tarafından Streptomyces clavuligerus bakterisinden keşfedilmiştir.[12] Birkaç denemeden sonra Beecham nihayet 1981 yılında ilaç için ABD patent koruması başvurusunda bulundu ve 1985 yılında 4,525,352, 4,529,720 ve 4,560,552 numaralı ABD Patentleri verildi.
Klavulanik asit, β-laktam antibiyotiklerin karakteristik özelliği olan β-laktam halkasını paylaşmasına rağmen ihmal edilebilir bir içsel antimikrobiyal aktiviteye sahiptir. Bununla birlikte, kimyasal yapıdaki benzerlik, molekülün bazı bakteriler tarafından salgılanan β-laktamaz enzimi ile etkileşime girerek β-laktam antibiyotiklere direnç kazandırmasını sağlar.
Klavulanik asit, β-laktamazın aktif bölgesindeki bir serin kalıntısına kovalent olarak bağlanan bir intihar inhibitörüdür. Bu, klavulanik asit molekülünü yeniden yapılandırarak, aktif bölgedeki başka bir amino aside saldıran, onu kalıcı olarak etkisiz hale getiren ve böylece enzimi etkisiz hale getiren çok daha reaktif bir tür oluşturur.
Bu inhibisyon, laktamaz salgılayan dirençli bakterilere karşı β-laktam antibiyotiklerin antimikrobiyal aktivitesini geri kazandırır. Buna rağmen, bu tür kombinasyonlara bile dirençli olan bazı bakteri suşları ortaya çıkmıştır.
Kaynakça
- ^ Fischer J, Ganellin CR (2006). Analogue-based Drug Discovery (İngilizce). John Wiley & Sons. s. 490. ISBN 9783527607495.
- ^ Joint Formulary Committee. British National Formulary, 47th edition. London: British Medical Association and Royal Pharmaceutical Society of Great Britain; 2004.
- ^ "Drug Record - Amoxicillin-Clavulanate". LiverTox - Clinical and Research Information on Drug-Induced Liver Injury. 2012. PMID 31643176. 23 Kasım 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 24 Nisan 2013.
- ^ Tortajada Girbés M, Ferrer Franco A, Gracia Antequera M, Clement Paredes A, García Muñoz E, Tallón Guerola M (2008). "Hypersensitivity to clavulanic acid in children". Allergologia et Immunopathologia. 36 (5). ss. 308-310. doi:10.1016/S0301-0546(08)75228-5. PMID 19080805. 7 Nisan 2012 tarihinde kaynağından arşivlendi. Erişim tarihi: 11 Kasım 2011.
- ^ Arulanantham H, Kershaw NJ, Hewitson KS, Hughes CE, Thirkettle JE, Schofield CJ (January 2006). "ORF17 from the clavulanic acid biosynthesis gene cluster catalyzes the ATP-dependent formation of N-glycyl-clavaminic acid". The Journal of Biological Chemistry. 281 (1). ss. 279-287. doi:10.1074/jbc.M507711200. PMID 16251194.
- ^ Tahlan K, Park HU, Wong A, Beatty PH, Jensen SE (March 2004). "Two sets of paralogous genes encode the enzymes involved in the early stages of clavulanic acid and clavam metabolite biosynthesis in Streptomyces clavuligerus". Antimicrobial Agents and Chemotherapy. 48 (3). ss. 930-939. doi:10.1128/AAC.48.3.930-939.2004. PMC 353097 $2. PMID 14982786.
- ^ a b c d e Townsend CA (October 2002). "New reactions in clavulanic acid biosynthesis". Current Opinion in Chemical Biology. 6 (5). ss. 583-589. doi:10.1016/S1367-5931(02)00392-7. PMID 12413541.
- ^ Reading C, Cole M (May 1977). "Clavulanic acid: a beta-lactamase-inhiting beta-lactam from Streptomyces clavuligerus". Antimicrobial Agents and Chemotherapy. 11 (5). ss. 852-857. doi:10.1128/AAC.11.5.852. PMC 352086 $2. PMID 879738.
- ^ Busby RW, Townsend CA (July 1996). "A single monomeric iron center in clavaminate synthase catalyzes three nonsuccessive oxidative transformations". Bioorganic & Medicinal Chemistry. 4 (7). ss. 1059-1064. doi:10.1016/0968-0896(96)00088-0. PMID 8831977.
- ^ Bachmann BO, Townsend CA (September 2000). "Kinetic mechanism of the beta-lactam synthetase of Streptomyces clavuligerus". Biochemistry. 39 (37). ss. 11187-11193. doi:10.1021/bi000709i. PMID 10985764.
- ^ Khaleeli N, Li R, Townsend CA (1999). "Origin of the β-Lactam Carbons in Clavulanic Acid from an Unusual Thiamine Pyrophosphate-Mediated Reaction". Journal of the American Chemical Society. 121 (39). ss. 9223-9224. doi:10.1021/ja9923134.
- ^ Sutherland R (June 1991). "Beta-lactamase inhibitors and reversal of antibiotic resistance". Trends in Pharmacological Sciences. 12 (6). ss. 227-232. doi:10.1016/0165-6147(91)90557-9. PMID 2048218.