Kimya, maddenin yapısını, özelliklerini, birleşimlerini, etkileşimlerini, tepkimelerini araştıran ve uygulayan bilim dalıdır. Kimya bilmi daha kapsamlı bir ifadeyle maddelerin özellikleriyle, sınıflandırılmasıyla, atomlarla, atom teorisiyle, kimyasal bileşiklerle, kimyasal tepkimelerle, maddenin hâlleriyle, moleküller arası ve moleküler kuvvetlerle, kimyasal bağlarla, tepkime kinetiğiyle, kimyasal dengenin prensipleriyle vb konularla ilgilenir. Kimyanın en önemli dalları arasında analitik kimya, anorganik kimya, organik kimya, fizikokimya ve biyokimya sayılır.

Hidrojen, sembolü H, atom numarası 1 olan kimyasal bir element. Standart sıcaklık ve basınç altında renksiz, kokusuz, metalik olmayan, tatsız, oldukça yanıcı ve H2 olarak bulunan bir diatomik gazdır. 1,00794 g/mol'lük atomik kütlesi ile tüm elementler arasında en hafif olanıdır. Periyodik cetvelin sol üst köşesinde yer alır. Hidrojenin adı, Yunancada "su oluşturan" anlamına gelen ὑδρογόνο'dan (idrogono) kelimesinden gelir.

Karbon, doğada yaygın bulunan ametal kimyasal elementtir. Evrende bolluk bakımından altıncı sırada yer alan karbon, kızgın yıldızlarda hidrojenin termonükleer yanmasında temel rol oynar. Dünyada hem doğal halde, hem de başka elementlerle bileşik halinde bulunan karbon, ağırlık olarak Dünya'nın yerkabuğunun yaklaşık %0,2'sini oluşturur. En arı (katışıksız) biçimleri elmas ve grafittir; daha düşük arılık derecelerinde maden kömürünün, kok kömürünün ve odun kömürünün bileşeni olarak bulunur. Atmosferin yaklaşık % 0,05'ini oluşturan ve bütün doğal sularda erimiş olarak bulunan karbon dioksit, kireç taşı ve mermer gibi karbonat mineralleri, kömürün, petrolün ve doğalgazın başlıca yapıtaşları olan hidrokarbonlar, en bol bulunan bileşikleridir.

Elektron dizilimi, atom fiziği ve kuantum kimyasında, bir atom ya da molekülün elektronlarının atomik ya da moleküler orbitallerdeki dağılımıdır. Örneğin Neon atomunun elektron dizilimi 1s2 2s2 2p6 olarak gösterilir.
İngilizce simplified molecular input line entry specification deyiminin kısaltması olan SMILES molekül yapılarının kısa ASCII dizileri şeklinde kesin olarak tanımlanabilmesi için geliştirilmiş bir sistemdir. Çoğu kimyasal çizim programı SMILES dizilerini okuyup bunları iki boyutlu çizimlere veya üç boyutlu modellere dönüştürebilirler.

Bir kimyasal bileşiğin molekül kütlesi, bu bileşiğin bir molekülünün birleşik atom kütle birimi u cinsinden kütlesidir. Bağıl bir değer olduğundan bir maddenin molekül kütlesine yaygın olarak bağıl moleküler kütle denir ve Mr. diye de kısaltılır.

Avogadro sayısı kadar atom ya da molekül içeren maddeye 1 mol denir. Mol, hiçbir zaman belli bir kütleyi ifade etmez.

Molekül, birbirine bağlı gruplar halindeki atomların oluşturduğu kimyasal bileşiklerin en küçük temel yapısına verilen addır. Diğer bir ifadeyle bir molekül bir bileşiği oluşturan atomların eşit oranlarda bulunduğu en küçük birimdir. Moleküller yapılarında birden fazla atom içerirler. Bir molekül aynı iki atomun bağlanması sonucu ya da farklı sayılarda farklı atomların bağlanması sonucunda oluşabilirler. Bir su molekülü 3 atomdan oluşur; iki hidrojen ve bir oksijen. Bir hidrojen peroksit molekülü iki hidrojen ve 2 oksijen atomundan oluşur. Diğer taraftan bir kan proteini olan gamma globulin 1996 sayıda atomdan oluşmakla birlikte sadece 4 çeşit farklı atom içerir; hidrojen, karbon, oksijen ve nitrojen. Molekülleri oluşturan kimyasal bağlara Moleküler bağlar denir. Bunlar kovalent, iyonik ve metalik bağlardır.

Organik kimya, organik bileşiklerin ve organik maddelerin yani karbon atomlarını içeren çeşitli formlardaki maddelerin yapısını, özelliklerini ve reaksiyonların bilimsel çalışmasını içeren, kimyanın bir alt dalıdır. Yapının incelenmesi yapısal formüllerini belirler. Özelliklerin incelenmesi, fiziksel ve kimyasal özellikleri ve davranışlarını anlamak için kimyasal reaktivitenin değerlendirilmesidir. Organik reaksiyonların incelenmesi doğal ürünlerin, ilaçların ve polimerlerin kimyasal sentezini ve bireysel organik moleküllerin laboratuvarda ve teorik çalışma yoluyla incelenmesidir.

Kimya'da, hidrojen bağı öncelikle daha elektronegatif bir "verici" atom veya gruba (Dn) kovalent bağla bağlanan bir hidrojen (H) atomu ile ve yalnız bir çift elektron taşıyan başka bir elektronegatif atom arasındaki elektrostatik çekim kuvvetidir.

Kovalent bağ, atomlar arasında elektron çiftleri oluşturmak için elektronların paylaşımını içeren kimyasal bağdır. Bu elektron çiftlerine paylaşılan çiftler veya bağ çiftleri denir. Atomlar arasında elektronları paylaştıklarında çekici ve itici kuvvetlerin kararlı dengesine kovalent bağ denir. Birçok molekül için elektronların paylaşılması her atomun kararlı elektronik gruplaşmasına denk gelen tam değerlik kabuğunun eşdeğerine ulaşmasına olanak tanır.

Kimyasal bileşik, kimyasal bağlarla bir arada tutulan birden fazla kimyasal elementin atomlarını içeren birçok özdeş molekülden oluşan kimyasal maddedir. Dolayısıyla tek bir elementin atomlarından oluşan bir molekül bileşik değildir. Bir bileşik, diğer maddelerle etkileşimi içerebilen kimyasal reaksiyonla farklı bir maddeye dönüştürülebilir. Bu süreçte atomlar arasındaki bağlar kırılabilir ve/veya yeni bağlar oluşabilir.

Enerji seviyesi, atom çekirdeğinin etrafında katman katman biçiminde bulunan kısımların her biridir. Bu yörüngelerde elektronlar bulunur. Yörüngenin numarası; 1, 2, 3, 4, ... gibi sayı değerlerini alabilir. Yörünge numarasına baş kuantum sayısı da denir ve "n" ile gösterilir. Yörünge numarası ile yörüngenin çekirdeğe uzaklığı doğru orantılıdır.

Organik kimyada fonksiyonel grup, içinde bulundukları moleküllerin karakteristik kimyasal tepkimelerinden sorumlu belli atom gruplarıdır. Aynı fonksiyonel grup aynı veya benzer kimyasal tepkimere girer, ait olduğu molekülün büyüklüğünden bağımsız olarak.

Organik kimyada bazı atom halkalarının yapısı beklenenin üstünde kararlıdır. Doymamış bağlar, yalın elektron çiftleri veya boş orbitallerden oluşan konjüge bir halkanın konjüge olmasından beklenecek kararlılıktan daha yüksek bir kararlılık gösterme özelliğine aromatiklik denir. Aromatiklik, halkasal delokalizasyon ve rezonansın bir belirtisi olarak da düşünülebilir.

Kimyasal madde, kimyevî madde veya kısaca kimyasal, sabit bir kimyasal bileşimi ve karakteristik özelliklere sahip bir madde türüdür. Bu kimyasal bağlar bozulmadan, fiziksel ayırma yöntemleri ile bileşenlerine ayrılmaz. Bu kimyasallar katı, sıvı veya gaz hâlinde olurlar.
Kimyada kimyasal enerji, pil, ampul ve hücre gibi bir kimyasal maddenin tepkime esnasındaki değişiminin potansiyelidir. Kimyasal bağ kurma veya koparma sonucu enerji açığa çıkar. Bu enerji bir kimyasal sistem tarafından ya emilir ya da yayılır.
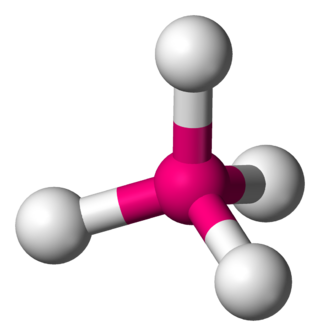
Dörtyüzlü veya tetrahedral molekül geometrisi, merkezi atomun, dört yüzlünün ortasında, dört köşede ise sübstitüentlerin yer aldığı molekül geometrisidir. Bağ açıları, dört sübstitüent aynı olduğunda (örn. metan CH4 ya da daha ağır analogları) cos−1 (-⅓) = 109,4712206 ...° ≈ 109.5° olur. Metan veya diğer simetrik yüzlü moleküller Td nokta grubuna aittir, ama dörtyüzlü moleküller genellikle düşük simetriye sahiptir. Tetrahedral moleküller kiral olabilir.
Kimyasal bileşim, kimyasal ve atomik bağlar yoluyla bir bileşiği oluşturan elementlerin kimliğini, düzenini ve oranını belirten bir terimdir.
Kimyada izotopologlar yalnızca izotopik bileşimleri bakımından farklılık gösteren moleküllerdir. Aynı kimyasal formüle ve atomların bağlanma düzenine sahiptirler, ancak en az bir atom ana atomdan farklı sayıda nötrona sahiptir.






















