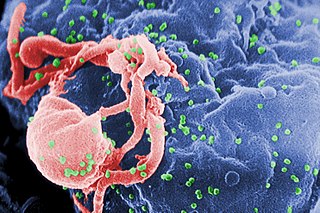
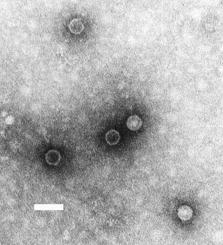
Kedi immün yetmezlik virüsü
| Kedi immün yetmezlik virüsü | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||
| Biyolojik sınıflandırma | |||||||||||||||||||||
| |||||||||||||||||||||
| İkili adlandırma | |||||||||||||||||||||
| Lentivirus Feline immunodeficiency virus | |||||||||||||||||||||
Kedi immün yetmezlik virüsü (ingilizce:Feline immunodeficiency virus) (FIV) dünya'da kedileri etkileyen bir Lentivirüs 'tür ve kedigillerin %2,5 ila %4,4'üne[1][2] bulaşır. FIV, diğer iki kedi retrovirüsünden, kedi lösemi virüsünden (FeLV) ve kedi köpüklü virüsten (FFV) taksonomik olarak farklıdır ve insan bağışıklık yetmezlik virüsü (HIV) ile daha yakından ilişkilidir. FIV içinde, viral zarf (env) veya polimeraz (pol) için kodlama yapan nükleotid dizi farklılıklarına dayalı olarak beş alt tip tanımlanmıştır. FIV, AIDS benzeri bir sendroma neden olan tek primat olmayan lentivirüstür, ancak FIV, hastalığın taşıyıcıları ve aktarıcıları olarak uzun yıllar nispeten sağlıklı yaşayabildikleri için kediler için genellikle ölümcül değildir. Etkinliği belirsizliğini korusa da bir aşısı vardır. Kediler aşılamadan sonra FIV antikorları için pozitif test yapacaktır.[3]
FIV ilk olarak 1986 yılında, UC Davis Veterinerlik Okulu'nda Niels C Pedersen ve Janet K. Yamamoto tarafından fırsatçı enfeksiyonların ve dejeneratif koşulların yüksek yaygınlığı olan ve orijinal olarak Feline T-lenfotropik virüs olarak adlandırılan bir kedi kolonisinde yalıtıldı.[4] O zamandan beri evcil kedilerde tanımlanmıştır.[5] FIV'in Afrika'da ortaya çıktığı ve o zamandan beri dünya çapında kedi türlerine yayıldığı öne sürülmüştür.
Etkileri
FIV, CD4+ ve CD8+ T lenfositleri, B lenfositleri ve makrofajlar dahil olmak üzere birçok hücre tipine bulaşarak kedilerin bağışıklık sistemini tehlikeye atar..FIV, kediler tarafından iyi tolere edilebilir, ancak sonunda, T-yardımcı (CD4+) hücrelerinin enfeksiyonu ve tükenmesi ile kedi konaklarında bağışıklık sisteminin zayıflamasına yol açabilir.
FIV ve HIV'in her ikisi de lentivirüslerdir. Ancak ne insanlara FIV, ne de kedilere HIV bulaşabilir. FIV, öncelikle, enfekte kedinin tükürüğünde bulunan virüsün başka bir kedinin vücut dokularına girdiği derin ısırık yaraları yoluyla bulaşır. FIV+ kedileri, su kaplarını, yemek kaplarını paylaşabilir, aynı kaseden ıslak mama yiyebilir ve hastalığı bulaştırma riski düşük olan aynı çöp kutusunu kullanabilir. İkincil enfeksiyonları tedavi eden uyanık bir evcil hayvan sahibi, enfekte olmuş bir kedinin oldukça uzun bir yaşam sürmesine izin verebilir. FIV ile enfekte olmuş bir kedinin virüsü evdeki diğer kedilere geçirme şansı, kediler arasında kavga olmadıkça veya virüsün enfekte kediden enfekte olmayan kediye girmesine izin verebilecek yaralar olmadıkça düşüktür.
Yeni doğan yavru kedilerin testi altı aya kadar pozitif olabilir ve daha sonra çoğu zaman yavaş yavaş negatif çıkacaktır. Bunun anne sütü yoluyla yavru kedilere aktarılan antikorlardan kaynaklandığı düşünülmektedir. Ancak bu antikorlar geçici olduğundan sonraki testler negatif olacaktır. FIV'e karşı aşılandıklarında, çeşitli kan testleri aşıya yanıt olarak gelişen antikorları saptayıp gösterdiğinden, gelecekte her zaman pozitif test yapacaklardır.
FIV, diğer kedi türlerinde bilinir ve aslında Afrika aslanları gibi bazı büyük vahşi kedilerde endemiktir. FIV'in üç ana klası 2006 itibarıyla tanınmaktadır, FIV-Ple (aslan), FIV-Fca (ev kedisi) ve FIV-Pco (puma).[6] Ev sahibi sınırları genellikle sınırlı tiplerine bağlı bakımlı APOBEC3 viral enzimleri Vif nötralize edebilir.[7]
Birleşik Devletlerde
Amerika Birleşik Devletleri'nde FIV ile enfekte olmuş kedilere ötanazi yapılması gerekip gerekmediği konusunda fikir birliği oluşturulmamıştır. Amerikan Kedi Uygulayıcıları Birliği (Amerika Birleşik Devletleri'ndeki bir kuruluş) ve birçok vahşi kedi kuruluşu, kısırlaştıran veya kısırlaştıran kedilerin etkili bir şekilde bulaşmayı kontrol ettiği göründüğünden, FIV-pozitif kedilere ötanazi yapılmamasını ve hatta virüsü test etmek için para harcanmasını önermez. kısırlaştırılmış kedilerin bölgesel kavgalara girme olasılığı daha düşüktür).[8]
Patoloji
Virüs, virüsün zarf glikoproteinleri (env glikoproteininden) ve hedef hücrelerin yüzey reseptörlerinin etkileşimi yoluyla konakçının hücrelerine giriş kazanır. İlk olarak, SU glikoproteini, konak hücre üzerindeki bir reseptör olan CD134'e bağlanır. Bu ilk bağlanma, SU proteininin şeklini, SU ile kemokin reseptörü CXCR4 arasındaki etkileşimi kolaylaştıracak şekilde değiştirir.[9] Bu etkileşim, viral ve hücresel membranların kaynaşmasına neden olarak viral RNA'nın sitoplazmaya transferine izin verir, burada ters kopyalanır ve homolog olmayan rekombinasyon yoluyla hücresel genoma entegre edilir. Konakçı hücrenin genomuna entegre edildikten sonra virüs, bağışıklık sistemi tarafından tespit edilmeden asemptomatik aşamada uzun süre uykuda kalabilir veya hücrenin parçalanmasına neden olabilir.[10][11]
CD134 ağırlıklı olarak aktive edilmiş T hücrelerinde bulunur ve OX40 ligandına bağlanarak T hücre uyarımı, proliferasyon, aktivasyon ve apoptoza neden olur (3). Bu, bağışıklık sisteminde kritik rolleri olan hücrelerde önemli bir düşüşe yol açar. Düşük CD4+ seviyeleri ve diğer etkilenen bağışıklık sistemi hücreleri, hastalık kediden edinilmiş bağışıklık eksikliği sendromuna (FAIDS) ilerlediğinde kedinin fırsatçı hastalıklara karşı duyarlı olmasına neden olur.[12]
Aktarma
Birincil bulaşma yolu, enfekte kedinin tükürüğünün diğer kedinin dokularına girdiği derin ısırık yaralarıdır. FIV ayrıca hamilelerden yavrularına rahim içinde de bulaşabilir; bununla birlikte, FIV ile enfekte olmuş yavru kedi ve adolesanların az sayıda olması nedeniyle, bu dikey geçişin nispeten nadir olduğu düşünülmektedir.[3][12] Bu, karşılıklı bakım ve yemek kaselerinin paylaşılması gibi daha rahat, saldırgan olmayan temasla yayılabilen FeLV'den farklıdır.
Enfeksiyon için risk faktörleri arasında erkek cinsiyet, yetişkinlik ve açık hava erişimi yer alır. São Paulo'da yürütülen bir vaka çalışması, FIV ile enfekte kedilerin yüzde 75'inin erkek olduğunu buldu. Erkeklerde dişilere göre daha yüksek enfeksiyon oranları, erkeklerin kendi bölgelerini savunan erkekler tarafından daha sık ısırılması nedeniyle oluşur.[11]
Hastalık aşamaları
FIV, insanlarda HIV'e benzer aşamalardan geçer. Başlangıç aşamasına veya akut faza, uyuşukluk, iştahsızlık, ateş ve lenfadenopati gibi hafif semptomlar eşlik eder.[12] Bu başlangıç evresi oldukça kısadır ve bunu asemptomatik evre izler. Burada kedi, değişken bir süre boyunca belirgin bir semptom göstermez. Bazı kediler bu gizli aşamada sadece birkaç ay kalırken, bazıları için yıllarca sürebilir. Asemptomatik aşamanın uzunluğunu etkileyen faktörler, enfekte eden virüsün patojenitesini ve FIV alt tipini (A–E), kedinin yaşını ve diğer patojenlere maruz kalmayı içerir. Son olarak, kedi, kaçınılmaz olarak ölüm nedeni olan ikincil hastalıklara karşı aşırı derecede hassas olduğu son aşamaya (kedi edinilmiş bağışıklık yetersizliği sendromu (FAIDS) aşaması olarak bilinir) ilerler.[11]
Testi
Veterinerler kedinin geçmişini kontrol eder, klinik belirtileri arar ve muhtemelen FIV antikorları için bir kan testi uygular. FIV, ABD'deki kedilerin %2-3'ünü etkiler ve testler kolaylıkla yapılabilir. Bu test, FIV antikorunu taşıyan ancak gerçek virüsü tespit etmeyen kedileri tanımlar.
Kedi antikoru taşıdığında (ki bu zararsızdır), ancak gerçek virüsü taşımadığında yanlış pozitifler ortaya çıkar. Bunun en sık meydana gelmesi, yavru kedilerin anne sütünden antikorları aldıktan sonra test edilmesi ve daha önce FIV için aşılanmış kedilerin test edilmesidir. Bu nedenle ne sekiz haftanın altındaki yavru kedilere ne de daha önce aşılanmış kedilere test yapılmaz.
FIV antikoru için pozitif test yapan yavru ve genç kediler, daha sonra FIV ile enfekte olmamış ve FIV aşısı ile bağışıklanmamış olmaları koşuluyla seroreversiyon nedeniyle negatif test edebilirler.
Aşılanmış kediler, enfekte olmasalar bile, serokonversiyon nedeniyle hayatlarının geri kalanında FIV antikoru için pozitif test yaparlar. Bu nedenle, geçmişte aşılanmış olup olmadıklarını bilmek imkansız olduğundan, sokak kedilerinin veya sahiplenilen kedilerin test edilmesi sonuçsuzdur. Bu nedenlerle, tek başına pozitif bir FIV antikor testi asla ötanazi için bir kriter olarak kullanılmamalıdır.[13]
Testler, bir veterinerin ofisinde dakikalar içinde sonuçlarla gerçekleştirilebilir ve hızlı konsültasyona olanak tanır. Erken teşhis, kedinin sağlığının korunmasına yardımcı olur ve enfeksiyonun diğer kedilere yayılmasını önler. Uygun bakım ile enfekte kediler uzun ve sağlıklı yaşayabilir.
Tedavi seçenekleri
2006 yılında, Amerika Birleşik Devletleri Tarım Bakanlığı, Lenfosit T-Hücre İmmünomodülatörü (LTCI) olarak adlandırılan yeni bir tedavi yardımı için şartlı bir lisans verdi.[14] Lenfosit T-Hücresi İmmünomodülatörü, yalnızca T-Cyte Therapeutics, Inc. tarafından üretilir ve dağıtılır.[15]
Lenfosit T-Hücre İmmünomodülatörü, kedi lösemi virüsü (FeLV) ve/veya kedi immün yetmezlik virüsü (FIV) ile enfekte olmuş kedilerin ve ilişkili lenfositopeni, fırsatçı enfeksiyon, anemi, granülositopeni veya trombositopeni semptomlarının tedavisinde yardımcı olarak tasarlanmıştır. Birkaç hayvan türünde gözlenen herhangi bir yan etkinin olmaması, ürünün çok düşük bir toksisite profiline sahip olduğunu göstermektedir.
Lenfosit T-Hücre İmmünomodülatörü, CD-4 lenfosit üretimi ve fonksiyonunun güçlü bir düzenleyicisidir.[16] Hayvanlarda lenfosit sayısını ve İnterlökin 2 üretimini arttırdığı gösterilmiştir.[17] Tek zincirli bir polipeptit ve güçlü bir katyonik glikoproteindir ve katyon değişim reçinesi ile saflaştırılır. Sığır türevli stromal hücre süpernatanlarından proteinin saflaştırılması, yabancı maddeler içermeyen büyük ölçüde homojen bir faktör üretir. Sığır proteini diğer memeli türleri ile homologdur ve izoelektrik noktası 6.5 olan homojen bir 50 kDa glikoproteindir. Protein, liyofilize 1 mikrogram dozda hazırlanır. Steril seyreltici içinde sulandırma, deri altı enjeksiyon için bir çözelti üretir.
Aşı
HIV'de olduğu gibi, FIV'e karşı da etkili bir aşının geliştirilmesi, virüs suşlarının varyasyonlarının yüksek sayısı ve aralarındaki farklılıklar nedeniyle zordur. "Tek tür" aşılar, yani yalnızca tek bir virüs varyantına karşı koruma sağlayan aşılar, homolog FIV türlerine karşı zaten iyi bir etkinlik göstermiştir. FIV için 2002 yılında piyasaya sürülen Fel-O-Vax adlı çift alt tipli bir aşı, kedileri daha fazla FIV suşuna karşı bağışıklamayı mümkün kıldı. Beş FIV alt tipinden (veya kladlarından) ikisinin inaktive edilmiş izolatları kullanılarak geliştirilmiştir: A Petaluma ve D Shizuoka.[18] Aşının, alt tip A FIV'e karşı orta derecede koruyucu olduğu (kedilerin %82'si korunmuştur)[19] ancak daha sonraki bir çalışma, alt tip A'ya karşı hiçbir koruma sağlamadığını gösterdi.[20] İki aşıya karşı %100 etkililik gösterdi. farklı alt tip B FIV suşları.[21][22] Aşılama, kedilerin FIV testlerinde pozitif sonuç almasına neden olarak tanıyı zorlaştıracaktır. Bu nedenlerden dolayı aşı "temel olmayan" olarak kabul edilir ve aşılama kararı bir veteriner ile tartışıldıktan ve riskler ve etkililik dikkate alındıktan sonra verilmelidir.[23]
Yapı

FIV, primat ve toynaklı lentivirüslere benzer bir yapı gösterir. Virion 80 ila 100 nanometre arasında bir çapa sahiptir ve pleomorfiktir . Viral zarf ayrıca 8 nm küçük yüzey çıkıntıları vardır ve yüzeyi eşit şekilde kaplar.[10]
IV virüs genomu diploiddir. Her durumda artı iplik oryantasyonunda mevcut olan yaklaşık 9400 nükleotidden oluşan iki özdeş tek iplikli RNA'dan oluşur. Retrovirüslerin tipik genomik yapısına sahiptir ve LTR, vif, pol, gag, orfA, env ve rev genlerini içerir.[24][25][26] Gag poliproteini, matris (MA), kapsid (CA) ve nükleokapsid (NC) proteinlerine bölünür. CA ve NC arasındaki bölünme, dokuz amino asitli bir peptidi serbest bırakırken, NC'nin C-terminalindeki bölünme bir 2kDa fragmanını (p2) serbest bırakır. Pol poliproteini, HIV ile paylaşılan bir özellik olan ribozomal çerçeve kaydırma ile çevrilir. Pol'ün viral proteaz tarafından bölünmesi, proteazın kendisini (PR), ters transkriptazı (RT), deoksiüridin trifosfatazı (dUTPase veya DU) ve integrazı (IN) serbest bırakır. Env poliproteini bir lider peptit (L), yüzey (SU) ve transmembran (TM) glikoproteinlerinden oluşur. Diğer lentivirüslerle ortak olarak, FIV genomu, Vif ve Rev proteinlerini kodlayan ek kısa açık okuma çerçevelerini (ORF'ler) kodlar. orfA (orf2 olarak da bilinir) olarak adlandırılan ek bir kısa ORF env geninden önce gelir. OrfA'nın viral replikasyondaki işlevi belirsizdir, ancak orfA ile kodlanmış ürün, Vpr, Vpu veya Nef gibi HIV-1 aksesuar gen ürünlerinin birçok özelliğini gösterebilir.
Bu alt tipler arasında genetik diziler çoğunlukla korunur; bununla birlikte, türe özgü FIV alt tipleri arasında geniş kapsamlı genetik farklılıklar mevcuttur. FIV genomu içinde Pol , gag ile birlikte FIV suşları arasında en çok korunandır. Aksine env, vif, orfa ve rev FIV suşları arasında en az korunan ve en fazla genetik çeşitliliği sergileyenlerdir.[27]
Gag poliproteininden türetilen kapsid proteini, bir viral çekirdeğe (bir virüsün protein kabuğu) birleştirilir ve Gag'den türetilen matris proteini, lipid çift tabakasının hemen içinde bir kabuk oluşturur. Env poliproteini, yüzey glikoproteinini (SU) ve transmembran glikoproteini (TM) kodlar. Hem SU hem de TM glikoproteinleri, bilim adamlarının, virüs nötralize edici antikorlara virüs direnci veren Env glikoproteininin B hücresi epitoplarını maskeleyebileceğine inandıkları bir özellik olarak, yoğun şekilde glikosile edilmiştir.[10]
Lentiviral vektör
HIV-1 gibi, FIV de gen terapisi için bir viral vektör olarak tasarlanmıştır.[28] Diğer lentiviral vektörler gibi, FIV vektörleri de konakçı hücrenin kromozomuna entegre olur ve burada uzun süreli stabil transgen ekspresyonu üretebilir. Ayrıca vektörler bölünen ve bölünmeyen hücrelerde kullanılabilir.[28][29] FIV vektörleri potansiyel olarak Parkinson hastalığı gibi nörolojik bozuklukları tedavi etmek için kullanılabilir ve kanser için gen tedavisi olarak kullanım bulabilen transfer RNAi için zaten kullanılmıştır.[30]
Köken ve yayılma
FIV'in kedigillerde kesin kökenleri ve ortaya çıkışı bilinmemektedir; bununla birlikte, viral filogenetik, kedigiller türleşmesi ve FIV oluşumu ile ilgili çalışmalar, Afrika'daki kökenlere değinmektedir. Viral filogenetik analizi, genellikle hızlı evrimle yeni ortaya çıkan virüsler tarafından gösterilen, yıldız patlaması filogenetik modeline sahip filogenetik ağaçları gösterir.[31] Bununla birlikte, topolojideki farklılıklar, dal uzunlukları, yüksek genetik sapma, kedigil türlerinde daha eski bir kökene işaret etmektedir. Fosil kayıtları, mevcut kedigillerin yaklaşık 10,8 milyon yıl önce Asya'da ortak bir atadan ortaya çıktığını ve o zamandan beri sekiz farklı evrimsel soydan otuz sekiz türün Antarktika dışında her kıtaya yayıldığını ve başarılı bir şekilde yaşadığını gösteriyor.[24] Asya'daki kedigiller kökenlerine rağmen, Moğol Pallas kedisi dışında Asya'daki kedigil türlerinde FIV yoktur; ancak FIV, Afrika'da yüksek oranda endemiktir ve beş kediden dördünde seropozitif PCR sonuçları vardır.[32] FIV suşlarının Afrika'da yaygın olarak görülmesi ve türler arası farklılıklar nedeniyle, FIV'ün dünyaya yayılmadan önce Afrika'da ortaya çıktığı ileri sürülmektedir. Afrika kedigil türlerinde FIV lekeleri ile sırtlan FIV-Ccr'nin varlığı arasındaki yüksek genetik çeşitlilik ve farklılık, türler arasında türler arası geçiş için artan fırsatlara yol açan uzun bir kalma süresi ile tutarlıdır. Ek olarak, lentivirüsler Afrika'da sadece kedigilleri değil, aynı zamanda primatları ve toynaklı türleri de enfekte eden oldukça endemiktir. Bu, tüm lentivirüslerin kökenlerine işaret eder ve Afrika'daki FIV kökenlerini destekler; ancak, daha fazla araştırmaya ihtiyaç vardır.[33][34]
FIV'ün Afrika'dan yayılması, kedigiller göçünün iki noktasında meydana gelmiş olabilir. Bering Boğazı'ndan Kuzey Amerika'ya en erken göç, yaklaşık 4,5 milyon yıl önce deniz seviyesinin düşük olduğu bir dönemde meydana geldi.[35] Kuzey Amerika'daki ilk kedigiller, ocelot soyunun yedi türüne, puma soyunun iki türüne ve modern vaşak türlerinin dördüne indi.[36] Asya aslanlarının ve jaguarlarının Avrasya boyunca Kuzey ve Güney Amerika'ya en son göçü Pliyosen/erken Pleistosen sırasında meydana geldi.[35] Bu göç olayları, kedigiller arasında FIV bulaşma fırsatlarını artırdı ve kedigiller türleri için küresel olarak yerleşik enfeksiyonlar.
Evrim
Vahşi kedigiller
FIV alt tiplerinin karşılaştırmaları, hızlı evrimi gösterir ve FIV suşlarındaki farklılığı vurgular. Amerikan pumalarına özgü olan FIV-Pco'nun birbirinden oldukça farklı iki alt tipi vardır.[37] Birkaç çalışma, A ve B alt tiplerinin uzun dal uzunluklarına ve düşük coğrafi benzerliklere sahip olduğunu göstermiştir; bu, uzun bir ikamet süresi ile birleştiğinde popülasyonlara iki ayrı FIV girişi olasılığını gösterir.[37] Geç Pleistosen'de pumalar buzul çağının kurbanı oldular, Florida'daki küçük bir akraba popülasyonu dışında Kuzey Amerika'da soyu tükendi ve 10-12,000 yıl öncesine kadar yeniden ortaya çıkmadı.[35][38] Orta, Güney ve Kuzey Amerika'daki FIV-Pco suşlarının filogenetik analizi, Orta ve Güney Amerika suşlarının Kuzey Amerika suşları ile birbirine olduğundan daha yakın akraba olduğunu göstermektedir.[37][39] Bu, FIV-Pco'nun Kuzey Amerika'yı yeniden dolduran Güney Amerika pumalarında zaten mevcut olduğunu gösteriyor.[39] Afrika aslanlarında, FIV-Ple, bir dereceye kadar farklı coğrafi endemisite sergileyen altı AF alt tipine ayrılmıştır.[40] Yaklaşık 2 milyon yıl önce, Afrika aslanları Afrika, Asya ve Kuzey, Orta ve Güney Amerika'da ortaya çıktı ve dağıldı. Modern aslanlar şu anda Hindistan'daki küçük bir nüfus dışında yalnızca Afrika kıtasında yaşar.[35] FIV'ün belgelenmiş bir hastalık ilişkisi yoktur, ancak serbest dolaşan aslan popülasyonlarında seroprevalansın kabaca %90 olduğu tahmin edilmektedir.[41] FIV-Ple alt tipleri A, B ve C'nin filogenetik analizi, diğer Felidae türlerinden gelen suşlara kıyasla yüksek birey içi ve bireyler arası genetik çeşitlilik ve dizi farklılığı gösterir.[25] Bu bulgular, bu suşların coğrafi olarak uzak aslan popülasyonlarında evrimleştiğini göstermektedir; bununla birlikte, bu suşların Serengeti Ulusal Parkı'ndaki popülasyonlar içinde son zamanlarda ortaya çıkması, aynı popülasyonda yakın zamanda yakınsamanın olduğunu düşündürmektedir.
Yerli kedigiller
Evcil kedilerde FIV-Fca patojeniktir ve kedi AIDS semptomlarına ve ardından ölüme yol açabilir. Filogenetik analiz, FIV'ün A, B ve C olmak üzere üç alt tipe ayrılan monofiletik bir dal olduğunu göstermektedir.[27] Evcil kediler, Doğu Asya'da yaşayan yaban kedisi Felis silvestris'in bir alt türünden yaklaşık 10,000 yıl önce diğer kedigil türlerinden daha yakın zamanda ortaya çıkmıştır. Genetik analiz, evcil kedide vahşi Felidae türlerine kıyasla daha düşük FIV genetik çeşitliliğine, daha yüksek evrim oranlarına ve FIV-Ple ve FIV-Pco'ya kıyasla daha yüksek ölüm oranlarına işaret eder.[42] Bu, yeni ortaya çıkan virüslerin daha yüksek evrim oranlarına sahip olma eğiliminde olduğu ve virüs ile yeni konakçı türler arasında çok az veya hiç eş-adaptasyon olmadığı için, evcil kedilerde FIV'in ortaya çıkışının yakın zamanda olduğunu gösterir.[27] Ek olarak, seroprevalans çalışmaları, refakatçi kedilerde %4-12, vahşi kedilerde ise %8-19'luk bir prevalansa sahip olduğunu göstermektedir ki bu, FIV'in bu türde yakın zamanda ortaya çıktığı hipotezini destekleyen yabani kedigil türlerine kıyasla çok daha düşüktür.[43][44]
Kedi lösemi virüsü ile karşılaştırma
FIV ve kedi lösemi virüsü (FeLV), virüsler birçok yönden farklılık gösterse de bazen birbiriyle karıştırılır. Her ikisi de aynı retroviral alt ailede (orthoretrovirinae) olmalarına rağmen, farklı cinslerde sınıflandırılırlar (FeLV bir gama-retrovirüstür ve FIV, HIV-1 gibi bir lentivirüstür). Şekilleri oldukça farklıdır: FIV uzamışken FeLV daha daireseldir. İki virüs de genetik olarak oldukça farklıdır ve protein kaplamaları boyut ve bileşim bakımından farklılık gösterir. FeLV ve FIV'ün neden olduğu hastalıkların çoğu benzer olsa da, neden oldukları spesifik yollar da farklıdır. Ayrıca kedi lösemi virüsü, enfekte olmuş bir kedide semptomatik hastalığa neden olabilirken, FIV ile enfekte bir kedi tüm yaşamı boyunca tamamen asemptomatik kalabilir.
Ayrıca bakınız
- Kedi aşısı
- Winn Kedi Vakfı
Dış bağlantılar
- Lenfosit T-Hücre İmmünomodülatörü (LTCI) 31 Temmuz 2012 tarihinde Wayback Machine sitesinde arşivlendi.
- WikiVet İnceleme Kedi İmmün Yetmezlik Virüsü 6 Ağustos 2021 tarihinde Wayback Machine sitesinde arşivlendi.
Kaynakça
- ^ "Occurrence of feline immunodeficiency virus infection in cats", Ciência Rural, 38 (8), 2008, s. 2245, doi:10.1590/S0103-84782008000800024
- ^ "Feline immunodeficiency virus vaccine: Implications for diagnostic testing and disease management", Biologicals, 33 (4), 2005, ss. 215-7, doi:10.1016/j.biologicals.2005.08.004, PMID 16257536
- ^ a b "Feline Immunodeficiency Virus", Cornell Feline Health Center, Cornell University, College of Veterinary Medicine, 2002, 6 Şubat 2010 tarihinde kaynağından arşivlendi, erişim tarihi: 12 Kasım 2008
- ^ "Isolation of a T-lymphotropic virus from domestic cats with an immunodeficiency-like syndrome", Science, 235 (4790), 1987, ss. 790-793, doi:10.1126/science.3643650, PMID 3643650
- ^ "Feline immunodeficiency virus vaccine: A rational paradigm for clinical decision-making", Biologicals, 33 (4), 2005, ss. 219-20, doi:10.1016/j.biologicals.2005.08.012, PMID 16257537
- ^ Troyer (15 Ekim 2011). "FIV diversity: FIV Ple subtype composition may influence disease outcome in African lions". Veterinary Immunology and Immunopathology. 143 (3–4): 338-46. doi:10.1016/j.vetimm.2011.06.013. PMC 3168974 $2. PMID 21723622.
- ^ Konno (10 Nisan 2018). "New World feline APOBEC3 potently controls inter-genus lentiviral transmission". Retrovirology. 15 (1): 31. doi:10.1186/s12977-018-0414-5. PMC 5894237 $2. PMID 29636069.
- ^ Little (9 Ocak 2020). "2020 AAFP Feline Retrovirus Testing and Management Guidelines". Journal of Feline Medicine and Surgery. 22 (1): 5-30. doi:10.1177/1098612X19895940. PMID 31916872.
- ^ Hu (2012). "Mapping of Receptor Binding Interactions with the Fiv Surface Glycoprotein (SU); Implications Regarding Immune survelliance and cellular Targets of Infection". Retrovirology: Research and Treatment. 1 (11): 1-11. doi:10.4137/RRT.S9429. PMC 3523734 $2. PMID 23255871.
- ^ a b c "Vaccination against the feline immunodeficiency virus: The road not taken", Comparative Immunology Microbiology & Infectious Disease, 31 (2–3), 12 Temmuz 2007, ss. 167-190, doi:10.1016/j.cimid.2007.07.007, PMID 17706778, 27 Mart 2014 tarihinde kaynağından arşivlendi, erişim tarihi: 15 Kasım 2011
- ^ a b c "Clinical aspects of feline immunodeficiency and feline leukemia virus infection", Veterinary Immunology and Immunopathy, 143 (3–4), 2011, ss. 190-201, doi:10.1016/j.vetimm.2011.06.003, PMC 7132395 $2, PMID 21807418, 27 Mart 2014 tarihinde kaynağından arşivlendi, erişim tarihi: 16 Kasım 2011
- ^ a b c "Feline immunodeficiency virus model for designing HIV/AIDS vaccines", Current HIV Research, 8 (1), 2010, ss. 14-25, doi:10.2174/157016210790416361, PMC 3721975 $2, PMID 20210778
- ^ "Feline immunodeficiency. ABCD guidelines on prevention and management", Journal of Feline Medicine & Surgery, 11 (7), 2009, ss. 575-84, doi:10.1016/j.jfms.2009.05.006, PMC 7129779 $2, PMID 19481037
- ^ LTCI Product Information, T-Cyte Therapeutics, Inc., 16 Ağustos 2012 tarihinde kaynağından arşivlendi, erişim tarihi: 28 Temmuz 2012
- ^ T-Cyte Therapeutics, Inc., T-Cyte Therapeutics, Inc., 31 Temmuz 2012 tarihinde kaynağından arşivlendi, erişim tarihi: 28 Temmuz 2012
- ^ Beardsley, et al. "Induction of T-Cell Maturation by a Cloned Line of Thymic Epithelium (TEPI) Immunology 80: pp. 6005-6009, (Oct. 1983).
- ^ US patent 7196060, Beardsley, Terry R., "Method to enhance hematopoiesis", 2005-05-19 tarihinde yayımlandı, 2007-03-27 tarihinde verildi
- ^ "2008 American Association of Feline Practitioners' feline retrovirus management guidelines", Journal of Feline Medicine & Surgery, 10 (3), 2008, ss. 300-16, doi:10.1016/j.jfms.2008.03.002, PMID 18455463
- ^ "Efficacy and safety of a feline immunodeficiency virus vaccine", Animal Health Research Reviews, 5 (2), 2004, ss. 295-300, doi:10.1079/AHR200487, PMID 15984343
- ^ "Limited efficacy of an inactivated feline immunodeficiency virus vaccine", Veterinary Record, 158 (16), 2006, ss. 561-562, doi:10.1136/vr.158.16.561, PMID 16632531
- ^ "Dual-subtype vaccine (Fel-O-Vax FIV) protects cats against contact challenge with heterologous subtype B FIV infected cats", Veterinary Microbiology, 108 (3–4), 2005, ss. 155-165, doi:10.1016/j.vetmic.2005.02.014, PMID 15899558
- ^ "Dual-subtype FIV vaccine (Fel-O-Vax FIV) protection against a heterologous subtype B FIV isolate", Journal of Feline Medicine and Surgery, 7 (1), 2005, ss. 65-70, doi:10.1016/j.jfms.2004.08.005, PMID 15686976
- ^ "2008 American Association of Feline Practitioners' feline retrovirus management guidelines", Journal of Feline Medicine & Surgery, 10 (3), 2008, ss. 300-316, doi:10.1016/j.jfms.2008.03.002, PMID 18455463
- ^ a b Pecon Slattery (March 1998). "Patterns of Y and X chromosome DNA sequence divergence during the Felidae radiation". Genetics. 148 (3): 1245-1255. doi:10.1093/genetics/148.3.1245. ISSN 0016-6731. PMC 1460026 $2. PMID 9539439.
- ^ a b Pecon-Slattery (2008). "Genomic organization, sequence divergence, and recombination of feline immunodeficiency virus from lions in the wild". BMC Genomics (İngilizce). 9 (1): 66. doi:10.1186/1471-2164-9-66. ISSN 1471-2164. PMC 2270836 $2. PMID 18251995.
- ^ Talbott (1 Ağustos 1989). "Nucleotide sequence and genomic organization of feline immunodeficiency virus". Proceedings of the National Academy of Sciences (İngilizce). 86 (15): 5743-5747. doi:10.1073/pnas.86.15.5743. ISSN 0027-8424. PMC 297706 $2. PMID 2762293.
- ^ a b c Carpenter (November 1998). "Phylogeographic Patterns of Feline Immunodeficiency Virus Genetic Diversity in the Domestic Cat". Virology (İngilizce). 251 (2): 234-243. doi:10.1006/viro.1998.9402. PMID 9837787. 2 Haziran 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ağustos 2021.
- ^ a b "Efficient transduction of nondividing cells by feline immunodeficiency virus lentiviral vectors", Nature Medicine, 4 (3), 1998, ss. 354-357, doi:10.1038/nm0398-354, PMID 9500613
- ^ "Optimization of Feline Immunodeficiency Virus Vectors for RNA Interference", J Virol, 80 (19), Oct 2006, ss. 9371-80, doi:10.1128/JVI.00958-06, PMC 1617215 $2, PMID 16973543
- ^ Carpenter (1996). "Genetic and phylogenetic divergence of feline immunodeficiency virus in the puma (Puma concolor)". Journal of Virology (İngilizce). 70 (10): 6682-6693. doi:10.1128/JVI.70.10.6682-6693.1996. ISSN 0022-538X. PMC 190710 $2. PMID 8794304.
- ^ Hofmann-Lehmann (September 1996). "Prevalence of antibodies to feline parvovirus, calicivirus, herpesvirus, coronavirus, and immunodeficiency virus and of feline leukemia virus antigen and the interrelationship of these viral infections in free-ranging lions in east Africa". Clinical and Diagnostic Laboratory Immunology. 3 (5): 554-562. doi:10.1128/CDLI.3.5.554-562.1996. ISSN 1071-412X. PMC 170405 $2. PMID 8877134.
- ^ Quérat (May 1987). "Characteristics of a novel lentivirus derived from South African sheep with pulmonary adenocarcinoma (jaagsiekte)". Virology (İngilizce). 158 (1): 158-167. doi:10.1016/0042-6822(87)90249-2. PMID 2437695. 17 Haziran 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ağustos 2021.
- ^ Hirsch (December 1995). "Phylogeny and natural history of the primate lentiviruses, SIV and HIV". Current Opinion in Genetics & Development (İngilizce). 5 (6): 798-806. doi:10.1016/0959-437X(95)80014-V. PMID 8745080. 28 Haziran 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ağustos 2021.
- ^ a b c d Johnson (6 Ocak 2006). "The Late Miocene Radiation of Modern Felidae: A Genetic Assessment". Science (İngilizce). 311 (5757): 73-77. doi:10.1126/science.1122277. ISSN 0036-8075. PMID 16400146.
- ^ Eizirik (January 2001). "Phylogeography, population history and conservation genetics of jaguars (Panthera onca, Mammalia, Felidae)". Molecular Ecology (İngilizce). 10 (1): 65-79. doi:10.1046/j.1365-294X.2001.01144.x. ISSN 0962-1083. PMID 11251788.
- ^ a b c Carpenter (October 1996). "Genetic and phylogenetic divergence of feline immunodeficiency virus in the puma (Puma concolor)". Journal of Virology. 70 (10): 6682-6693. doi:10.1128/JVI.70.10.6682-6693.1996. ISSN 0022-538X. PMC 190710 $2. PMID 8794304. 28 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ağustos 2021.
- ^ Antunes (7 Kasım 2008). Estoup, Arnaud (Ed.). "The Evolutionary Dynamics of the Lion Panthera leo Revealed by Host and Viral Population Genomics". PLOS Genetics (İngilizce). 4 (11): e1000251. doi:10.1371/journal.pgen.1000251. ISSN 1553-7404. PMC 2572142 $2. PMID 18989457.
- ^ a b Barr (February 1997). "Proviral Organization and Sequence Analysis of Feline Immunodeficiency Virus Isolated from a Pallas' Cat". Virology (İngilizce). 228 (1): 84-91. doi:10.1006/viro.1996.8358. PMID 9024812. 8 Haziran 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ağustos 2021.
- ^ Brown (1994). "A lion lentivirus related to feline immunodeficiency virus: epidemiologic and phylogenetic aspects". Journal of Virology (İngilizce). 68 (9): 5953-5968. doi:10.1128/JVI.68.9.5953-5968.1994. ISSN 0022-538X. PMC 237001 $2. PMID 8057472.
- ^ Lutz (December 1992). "Retrovirus infections in non-domestic felids: serological studies and attempts to isolate a lentivirus". Veterinary Immunology and Immunopathology (İngilizce). 35 (1–2): 215-224. doi:10.1016/0165-2427(92)90133-B. PMID 1337398. 28 Haziran 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ağustos 2021.
- ^ Olmsted (1 Ekim 1989). "Nucleotide sequence analysis of feline immunodeficiency virus: genome organization and relationship to other lentiviruses". Proceedings of the National Academy of Sciences (İngilizce). 86 (20): 8088-8092. doi:10.1073/pnas.86.20.8088. ISSN 0027-8424. PMC 298220 $2. PMID 2813380.
- ^ Fromont (2000). "Prevalence and pathogenicity of retroviruses in wildcats in France". Veterinary Record (İngilizce). 146 (11): 317-319. doi:10.1136/vr.146.11.317. ISSN 2042-7670. PMID 10766116. 23 Nisan 2021 tarihinde kaynağından arşivlendi. Erişim tarihi: 6 Ağustos 2021.
- ^ Troyer (1 Temmuz 2005). "Seroprevalence and Genomic Divergence of Circulating Strains of Feline Immunodeficiency Virus among Felidae and Hyaenidae Species". Journal of Virology (İngilizce). 79 (13): 8282-8294. doi:10.1128/JVI.79.13.8282-8294.2005. ISSN 0022-538X. PMC 1143723 $2. PMID 15956574.
- Proceedings, 2005, 19 Temmuz 2023 tarihinde kaynağından arşivlendi, erişim tarihi: 6 Ağustos 2021
- Feline Immunodeficiency Virus (FIV), 2004, 2 Şubat 2006 tarihinde kaynağından arşivlendi, erişim tarihi: 23 Ocak 2006
- Chapter, 2005[]
- FIV in African Lions, 2005, 1 Ağustos 2008 tarihinde kaynağından arşivlendi, erişim tarihi: 22 Temmuz 2008
- Should we release FIV+ cats?, 2001, 3 Mart 2016 tarihinde kaynağından arşivlendi, erişim tarihi: 17 Haziran 2014