Katı
| Sürekli ortamlar mekaniği |
|---|
 |
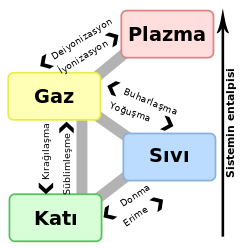
Katı, maddenin atomları arasındaki boşluğun en az olduğu halidir. "Katı" olarak adlandırılan bu haldeki maddelerin kütlesi, hacmi ve şekli belirlidir. Bir dış etkiye maruz kalmadıkça değişmez. Sıvıların aksine katılar akışkan değildir. Fiziksel yollarla, diğer üç hal olan sıvı, gaz ve plazmaya dönüştürülebilirler. Altın demir gibi madenler katı maddelere örnektir. Ayrıca katı maddeler atomlarının en yavaş hareket edebildiği haldir. Doğa'da amorf veya kristal yapıda bulunurlar. Amorf katılar maddenin taneciklerinin düzensiz olma durumudur. Kristal katılar ise de maddenin taneciklerinin düzenli olma durumudur. Kristal katılar da aralarında 4'e ayrılır.
Maddenin dört temel hâlinden biridir. Gaz ya da sıvı hâldeki madde katı hâle dönüşürken maddeyi oluşturan atomlar daha düzenli bir üç boyutlu yapıya geçer ve atomların enerjisi azalır. Katı durumdaki bir maddenin atomları arasındaki boşluk azalır. Bu nedenle aralarındaki çekim kuvveti de artar. Katı maddelerin biçim değiştirebilmesi için dışarıdan bir kuvvetin etki etmesi gerekir. Maddenin bu kuvvete göstereceği direniş, onun dayanıklılığını gösterir. Her maddeye göre değişen bu dayanıklılık belli katsayılarla gösterilir. Maddenin dayanıklılık özelliklerini mekanik bilimi inceler. Katıdan sıvıya, sıvıdan gaza dönüşürken ısı alır (enerji alır), tam tersi gazdan sıvıya, sıvıdan katıya dönüşürken ısı verir (enerji verir). Sıvıların sert bir görünüm almasına donma denir. Ayrıca tanecikleri sıkıştırılamaz katı cisimlerin hepsi belli bir kuvvete kadar dayanabilir esnekliğini kaybetmez yani onlara uygulanan kuvvet esnekligini sınırlayıp aşmıyorsa kuvvet kalkınca cisim eski haline geri döner.
Katıların Genel Özellikleri
Bütün maddeler atom ve moleküllerin çeşitli şekillerde bir araya gelmesiyle ortaya çıkar. Katıdaki atomlar, özellikle elektriksel karakterli kuvvetlerle, belirli konumlarda bir arada tutulurlar. Katı atomları bu denge konumları etrafında ısısal etkiler nedeniyle titreşim hareketi yaparlar. Fakat düşük sıcaklıklarda bu titreşim hareketi azdır ve atomlar hemen hemen sabit gibi düşünülebilir. Maddeye ısı enerjisi verilirse bu titreşim genliğini artırır.[1]
Erime noktası
Her katının bir erime noktası bulunur. Bir katıya ısı verildiğinde katının yapısındaki atomlar, iyonlar ya da moleküller daha şiddetli titreşirler. Sonunda bu titreşimlerin kristal yapısını bozacağı bir sıcaklığa ulaşılır; atomlar, iyonlar ya da moleküller birbirinin üzerinden kayar; katı, belli biçimini kaybeder ve sıvıya dönüşür. Bu olaya erime ve bu olayın gerçekleştiği noktadaki sıcaklığa erime noktası denir. Erime noktası ile madde miktarının bir ilgisi yoktur.[2]
"X" katısının erimesi ve donması için gereken sıcaklık aynıdır. Su 0 °C'de donup, 0 °C'de erir.
Erime ve donma noktası üzerine basıncın etkisi vardır. Normal erime noktasından söz edilirken, basınç Atmosfer olarak kabul edilir. Erime noktası, saf maddeler için karakteristik fiziksel bir sabittir.
Bazı hallerde erimiş madde, donma noktasına kadar soğuduğu halde donmaz. İşte bu duruma aşırı soğuma ve donmada gecikme denir. Bu haldeki sıvıya kendi cinsinden küçük bir katı billur atılırsa sıvı maddenin birdenbire donduğu görülür. Buna aşı billuru (kristali) denir. Erime noktası en düşük olan metal -38,83 °C ile Cıva (Hg)'dır. En yüksek erime noktasına sahip metal ise Tungsten veya diğer adıyla Volfram (W)'dır. Erime noktası 3412 °C'dir. Dayanıklı olmasından dolayı ampullerde kullanılır.[3]
Katı halden gaz hale geçiş
Katı halden gaz hale geçiş veya süblimleşme katı maddenin sıvı hale geçmeden direkt olarak maddenin gaz hale geçmesidir. Bu olayın tersine kırağılaşma denir. Gereken buharlaşma basıncına belli bir sıcaklıkta sahip olan bütün katılar genellikle süblimleşebilir. Karbon, arsenik gibi bazı maddelerin üçlü noktalarının yüksek olması dolayısıyla süblimleşmesi, eriyip buharlaşmasından daha kolaydır.
İletkenlik
Katıların bazıları ısıyı ve elektriği iyi iletirken bazıları iletmez. Bu olaya maddenin iletkenlik özelliği denir. Elektriksel iletkenlik bir iletken malzemeye uygulanan elektriksel alan etkisinde yük taşıyıcılarının uzak mesafeli hareketleri sonucu oluşur. Isı aktarımı ise; sıcaklıkları farklı iki veya daha fazla nesne arasında iletim, taşınım ya da ışınım yoluyla (veya bu yolların birbiri ile olan birleşimleri yoluyla) gerçekleşen enerji aktarımının incelenmesidir. Bu transferin matematiksel olarak modellenmesi ısı aktarımı dersinin temel konusunu oluşturur. Termodinamik, akışkanlar mekaniği ve malzeme ile ilişkilidir.
Katı Türleri
Katılar kendi arasında ikiye ayrılır. Bunlar; amorf ve kristal katılardır.
Amorf katılar
Düzensiz tanecik dizilimine sahip katılardır. Kristal katıların aksine belirli bir erime sıcaklıkları yoktur. Amorf katının erimeye başladığı sıcaklık değişkenlik gösterebilir.
Amorf katılar genellikle sıvı haldeki bir maddenin ani olarak soğutulması ile oluşturulur. Günlük hayatımızda bulunan cam, plastik, lastik, mum amorf katılara örnektir. Şekilleri de belirsizlik gösterir. Uzun süre beklemede akışkan olduğu gözlemlenmektedir. Amorf katıların belirli şekilleri yoktur.
Kristal katılar
Gördüğünüz tüm katıların en az %90'ı kristal katılar grubuna girer. Atomların, iyonların veya moleküllerin belli bir geometrik kalıba göre istiflenmesiyle oluşan katılara kristal katı denir. Kristal katıların yapı, erime noktası, yoğunluk, sertlik gibi fiziksel özellikleri bu katıları meydana getiren atom, iyon ve molekülleri bir arada tutan çekim kuvvetlerine bağlıdır.
Kristal katılar, tanecikler arası çekim kuvvetlerine göre iyonik, moleküler, kovalent, metalik olarak sınıflandırılır.[4]
Kaynakça
- ^ "Arşivlenmiş kopya". 5 Mart 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Mart 2017.
- ^ "Arşivlenmiş kopya". 6 Mart 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Mart 2017.
- ^ "Arşivlenmiş kopya". 6 Mart 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Mart 2017.
- ^ "Arşivlenmiş kopya". 5 Mart 2017 tarihinde kaynağından arşivlendi. Erişim tarihi: 5 Mart 2017.