Sodyum, periyodik cetvelde Na simgesi ile gösterilen ve atom numarası 11 olan element. Sodyum yumuşak ve kaygan bir metal olup alkali metaller grubuna aittir. Doğal bileşiklerin içinde bol miktarda bulunur. Yüksek oranda reaktiftir, sarı bir alevle yanar, su ile şiddetli reaksiyon verir ve havada hızla oksitlenir. Dolayısıyla, vazelin, gazyağı gibi hava ve su ile temasını kesecek bir ortamda saklanması gerekir.

Asit, pH derecesi 7'den düşük olup, değişen oranlarda yakıcı ve/veya aşındırıcı özelliğe sahip olan ve oldukça geniş kullanım alanına sahip kimyasal maddelere verilen isimdir. Suda çözündüklerinde hidrojen iyonu derişimini artırarak çözeltiyi asidik yapar. Mavi turnusol kâğıdının rengini kırmızıya çeviren asitlere eski Türkçede hamız veya ekşit denir.

Tuz, kimyada, bir asitle bir bazın tepkimeye girmesi neticesinde meydana gelen maddedir. Tuz, asitteki eksi yüklü iyonla (anyon) bazdaki artı yüklü iyondan (katyon) meydana gelir. Asitle baz arasındaki nötralleşme tepkimesi esnasında tuz ve su açığa çıkar. Erimiş tuz veya çözelti halindeki tuzların çoğu eksi ile artı yüklü iyonlarına ayrışır ve elektriği iletir. Tuz adı ayrıca sofra tuzu veya sodyum klorür (NaCl) için de kullanılır.

Rigor mortis veya ölüm sertliği, kaslardaki biyokimyasal bir değişiklikten kaynaklanan ve ölünün uzuvlarını katılaştıran bir ölüm belirtisidir. Bu olgu, oda sıcaklığındaki bir insanda ölümden 3-4 saat sonra görülmeye başlar, 12 saat sonra doruk noktasına ulaşır ve 36 saat sonra ortadan kalkar.
Baz, suda iyonlaştıklarında ortama OH− (hidroksit) iyonu ve elektron çifti verebilen maddelerdir. Bazlar da, asitler gibi tehlikeli maddelerdir. Suda iyonlaştıklarında hidroksit (OH−) iyonu derişimini arttıran maddelere baz denir. Bilinen en güçlü baz Sezyum hidroksittir (CsOH).

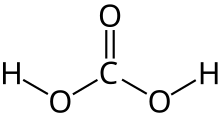
Karboksilik asitler karboksil grubu olan organik asitlerdir, -C(=O)OH formülüne sahiptirler, bu genelde -COOH veya CO2H olarak da yazılır. Karboksilik asitler Bronsted asitleridir, yani proton vericileridir. Karboksilik asitlerin tuz ve anyonlarına karboksilat denir. Karboksilik asitler, esterlerle fonsiyonel grup izomeridirler. Karboksilik asitlerin en basit dizisi alkanoik asitlerdir, R-COOH formülüyle gösterilirler, R bir hidrojen atomu veya bir alkil grubuna karşılık gelir. Bileşiklerde birden fazla karboksilik asit grubu bulunabilir.
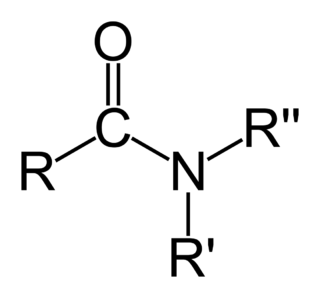
Kimyada amid sözcüğü iki anlama sahiptir: - Birinci anlamıyla amid, bir azot atomuna (N) bağlı bir karbonil grubu bulunduran bir organik fonksiyonel grup veya bu gruba sahip bir bileşiktir. - İkinci anlamıyla amid, bir azot anyonudur.

Sülfürik(VI) asit ya da halk arasında bilinen ismi ile zaç yağı, H2SO4, güçlü bir mineral asididir. Olası kâşifi 8. yüzyıl simyacısı Cabir bin Hayyan tarafından yenime uğratıcı, renksiz ve yoğunluğu yüksek sıvı olarak tanımlanmıştır. Suda her konsantrasyonda çözünebilir. Büyük ölçüde korozif oluşu, güçlü asidik yapısından ve dehidrasyon özelliğinden kaynaklanmaktadır.

Karbonik Anhidraz ya da karbonik dehidrataz, aktif bölgesinde çinko (Zn2+) iyonu içeren bir metaloenzim ailesidir ve yavaş bir reaksiyon olan karbondioksitin bikarbonat ve protona dönüşümünü katalizler. Karbonik anhidraz bu reaksiyonun hızını ileri derecede artırarak saniyede 104 – 106 reaksiyon hızına ulaştırır. Kırmızı kan hücrelerinde, hayvanların diğer kısımlarında ve bitkilerde bulunan, karbonik asidi karbondioksit ve suyla parçalayan enzim.
Hidrojen peroksit (H2O2), saf haldeyken oldukça açık mavi renkte; sulandırıldığında ise renksiz hale gelen bir bileşiktir. Viskozitesi sudan daha yüksek olan ve zayıf asidik özellik gösteren bileşik, aynı zamanda güçlü bir oksitleyicidir. Özellikle tıp alanında %3'lük sulu çözeltisi ve kâğıt sanayiinde kâğıtlara beyaz renk vermek için kullanılmaktadır. Bileşik ayrıca dezenfektasyon, oksitleme, antiseptik üretimi ve roket yakıtı üretiminde de tercih edilir.
Hidronyum (H3O) ;IUPAC'te adlandırılması oksonyum şeklindedir. Bir molekülünde 3 hidrojen ve 1 oksijen atomu bulunur. Hidronyum iyonu, (H3O) asitler suda çözündüklerinde açığa çıkan katyondur. Aynı zamanda asitleri bazlardan ayırmada kullanılır. (Brønsted-Lowry asit-baz teorisi)Bir asit suda çözündüğü zaman hidronyum katyonu ortaya çıkar. Bazı asit çözünme tepkimelerinde kolaylık olması amacıyla (H+) iyonu şeklinde de gösterilse de doğru kullanımı (H3O) şeklindedir. pH'ın belirlemesinde kullanılır. Eğer çözünen maddenin [H+] konsantrasyonu ile [OH-] eşitse o madde nötrdür.

Kükürtlü asit, sülfüröz asit ya da sülfürik(IV) asit formüllü H2SO3 olan bir kimyasal bileşiktir.
Bir asidin kuvveti, onun içinde bulunduğu çözeltiye ne kadar proton (H+) verebildiğinin ölçüsüdür. Kuvvetli asitler %100 çözünürler ve bu çözünme iyonlaşarak gerçekleşir. Yani 1 mol HA kuvvetli asidi suda çözündüğünde 1 mol H+ ve onun eşlenik bazı A- 1 mol oluşur. Hidroklorik asit, hidroiyodik asit, hidrobromik asit, perklorik asit, nitrik asit ve sülfürik asit, kuvvetli asitlere örnektir.

Ayrışma, çözünme veya günlenme, yerkabuğunu oluşturan kayaçların yüzey kısımlarında fiziksel ve kimyasal etkenlerle meydana gelen değişimlerdir. Bu etkenlerin yanında atmosferdeki gazlar, sıcaklık, su, organizmalar da ayrışmada etkilidir.

Bikarbonat tampon sistemi kandaki, onikiparmak bağırsaktaki ve diğer dokulardaki uygun metabolik işlevleri desteklemek amacıyla pH'ı koruyan, karbonik asit, bikarbonat iyonu ve karbondioksitin dengesini içeren bir asit-baz homeostaz mekanizması. Karbondioksit, hızlıca ve sırasıya bikarbonat ve hidrojen iyonlarına ayrışacak olan karbonik asiti oluşturmak için, suyla tepkime verir.Bu tepkime karbonik anhidraz ile katalize edilir.Tepkime aşağıda gösterilmiştir:
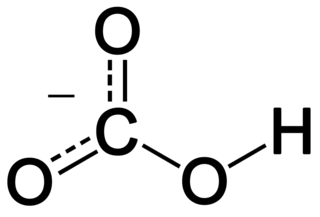
Bikarbonat, inorganik kimyada, (IUPAC-önerilen isim: hidrojen karbonat) karbonik asitin protonsuzlaştırılmasındaki bir ara yapı. HCO3− kimyasal formülene sahip moleküler iyondur.
Organik asit asidik özellik gösteren organik bileşikler için kullanılan terim. En yaygın organik asitler asitliği karboksil grubu (–COOH) ile ilişkili olan karboksilik asitlerdir. Sülfonoik asitler ise karboksil asitlere oranla daha güçlü asitlerdir. Alkoller asit görevi görebilirler fakat genellikle çok zayıf bir asitlik mevcuttur. Asitin konjuge bazının bağıl kararlılığı onun asitliliğini belirler. Ayrıca başka gruplarda, tiyol, enol, fenol ve -SH grubu gibi,genelde az etkileri olsa da, asitliliği belirleyebilir. Biyolojik sistemlerde, bahsi geçen organik grupları içeren organik bileşikler genellikle organik asitlere tekabül eder.

Hidrojen iyodür (HI) iki atomlu bir molekül ve hidrojen halojenürdür. Sulu çözeltisi, güçlü bir asit olan hidroiyodik asit veya hidriyodik asit olarak bilinir. Bununla birlikte, hidrojen iyodür ve hidroiodik asit, birincisinin standart koşullar altında bir gaz olması, diğerinin ise söz konusu gazın sulu bir çözeltisi olması bakımından farklıdır. Birbirine dönüştürülebilir. HI, organik ve inorganik sentezlerde birincil iyot kaynaklarından biri ve bir indirgeyici madde olarak kullanılır.

Hidrojen bromür, HBr formülüne sahip iki atomlu moleküldür. Renksiz bir bileşik ve bir hidrojen halojenürdür. Hidrobromik asit, su içinde bir HBr çözeltisidir. Hem HBr'nin susuz hem de sulu çözeltileri, bromür bileşiklerinin hazırlanmasında ortak reaktiflerdir.
Gümüş asetilür, formülü Ag2C2 olan bir metalik asetilür, inorganik kimyevi bileşiktir. Gümüş karbür olarak da bilinir. Nileşik, zayıf bir asit olan asetilenin tuzu olarak kabul edilir. Tuzun anyonu birbirine üçlü bağla bağlanmış iki karbon atomundan oluşur.