Karbonik anhidraz
| Karbonik anhidraz | |||||||
|---|---|---|---|---|---|---|---|
 | |||||||
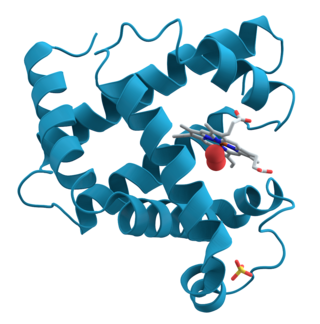
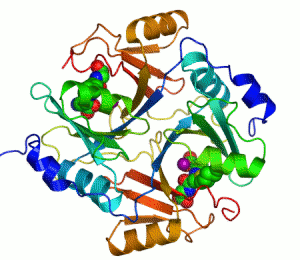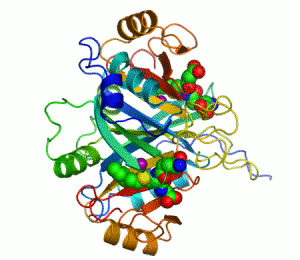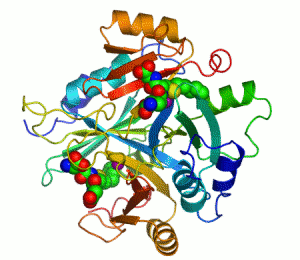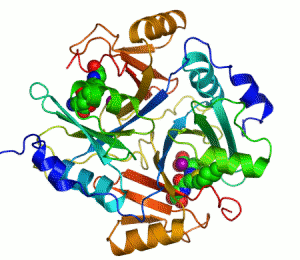
| İnsan karbonik anhidrazı Şerit diyagramı II, merkezinde Çinko iyonu görülmektedir. | |||||||
| Tanımlayıcılar | |||||||
| EC numarası | 4.2.1.1 | ||||||
| CAS numarası | 9001-03-0 | ||||||
| Veritabanları | |||||||
| IntEnz | IntEnz view | ||||||
| BRENDA | BRENDA entry | ||||||
| ExPASy | NiceZyme view | ||||||
| KEGG | KEGG entry | ||||||
| MetaCyc | metabolic pathway | ||||||
| PRIAM | profile | ||||||
| PDB structures | RCSB PDB PDBj PDBe PDBsum | ||||||
| Gene Ontology | AmiGO / EGO | ||||||
| |||||||
Ökaryotik tipi karbonik anhidraz | |
| Tanımlayıcılar | |
| Sembol | Carb_anhydrase |
| Diğer bilgiler | |
Karbonik Anhidraz ya da karbonik dehidrataz, aktif bölgesinde çinko (Zn2+) iyonu içeren bir metaloenzim ailesidir ve yavaş bir reaksiyon olan karbondioksitin bikarbonat ve protona dönüşümünü katalizler. Karbonik anhidraz bu reaksiyonun hızını ileri derecede artırarak saniyede 104 – 106 reaksiyon hızına ulaştırır. Kırmızı kan hücrelerinde, hayvanların diğer kısımlarında ve bitkilerde bulunan, karbonik asidi karbondioksit ve suyla parçalayan enzim.
Reaksiyon
CO2 + H2O --> HCO3- + H+
CO2 Difüzyonla kırmızı kan hücrelerine geçtiğinde, kırmızı kan hücrelerinde bulunan bu enzim sayesinde CO2 çok hızlı bir şekilde karbonikasit dönüştürülür. Karbonikasit ise, proton H+ ve bikarbonat HCO3- iyonlarına ayrılarak tekrar kana geçer ve kan ph'sının 7,4'te dengelenmesini sağlayarak doğal bir tampon çözelti gibi çalışır.
Enzim glokom tedavisi için bu tür asetazolamid, methazolamide ve dichlorphenamide gibi ilaçlar için bir hedeftir.[1]
Tarihçe ve Sınıflandırma
Karbonik anhidraz ilk defa eritrositlerden 1933 yılında saflaştırılmış[2] daha sonra yapılan yoğun çalışmalarda üç farklı tipte karakterize edilmiştir. Bunlardan hayvan ve bitki kökenli olanlar sırasıyla α ve β sınıfı içerisinde gruplandırılmışlardır. İzoenzimlerin hepsinde ortak olan nokta aktif bölgelerinde bir çinko (Zn+2) iyonu bulundurmalarıdır.
İlk tespit edilmiş ve üzerinde en fazla çalışma yapılmış izoenzimleri bünyesinde bulunduran α-sınıfındaki enzimler monomerik yapıdadır. Çok az sayıda prokaryotik α-sınıfı karbonik anhidraz tespit edilmiştir. α-Sınıfı karbonik anhidrazların katalitik mekanizmasında aktif bölgeden protonun dış çözücü ortamına aktarılmasında His-64 birimi aracı rol oynamaktadır. Proton His-64'e onunla çinko atomu arasındaki su molekülleri aracılığıyla aktarılır. Yapılan çalışmalar Lys-91 ve Tyr-131 birimlerinin de proton transfer mekanizmasında rol aldığını göstermektedir.
β-Sınıfındakiler çiftler şeklinde dimerler, tetramerler, hekzamerler ve oktamerler halindedirler. Bu sınıfa ait ilk kristal yapı 2000 yılında bildirilmiştir. Önceleri sadece bitkilerde bulunduğu sanılan bu sınıftaki izoenzimler sonraları alg, bakteri ve arkeon türlerinde de tespit edilmiştir. Bu sınıftaki izoenzimlerde aktif bölgedeki Zn atomu iki sistein ve bir histidin ligandlarıyla bağlanmaktadır. Dizi analizleri bu sınıftaki izoenzimlerde yalnızca beş aminoasit biriminin ve aktif bölgede üç çinko ligandının, bir aspartat ve bir de arginin birimlerinin korunmuş olduğunu göstermektedir. Yakın zamanda β-sınıfındaki izoenzimlerin bitki tipi ve Cab tipi diye iki alt gruba ayrılabileceği savunulmaktadır. Buna sebep aralarındaki yapısal fark ve inhibitörlere karşı verilen cevaptaki farklar gösterilmektedir.
Üçüncü sınıf olan γ enzimleri trimer yapıda olup bu sınıfın yapısı aydınlatılmış tek üyesi 1994'te archaeon Methanosarcina thermophila'dan izole edilmiş izoenzimdir. İzole edilen bu izoenzimin çinko yerine kobalt kullanıldığında daha yüksek hidrataz aktivitesi gösterdiği ve p-nitrofenil asetatla esteraz aktivitesi göstermediği tespit edilmiştir. Metal bağlanma bölgesinde α-sınıfındaki gibi üç histidin birimi ligand oluşturmaktadır, ancak bunların ikisi bir monomere, bir tanesi ise bitişikteki monomere aittir.
Son zamanlarda Thalassiosira weissflogii'den izole edilen karbonik anhidraz TWCA1'in diğer karbonik anhidraz sınıflarından ayrı bir sınıfa (δ-sınıfı) ait olduğu bildirilmiştir. TWCA1 diğer sınıflardaki karbonik anhidraz izoenzimlerine yapısal ve amino asit dizilişi bakımından benzememektedir.
Reaksiyon Mekanizması
Karbonik anhidrazın katalizlediği temel enzimatik olay karbondioksitin (CO2) hidrasyonudur.
CO2 + H2O --> HCO3- + H+
Kinetik çalışmalar bütün karbonik anhidraz izoenzimlerinde iki basamaklı bir mekanizmanın olduğunu göstermiştir. İlk basamakta (Reaksiyon 2) çinkoya bağlı hidroksit iyonunun CO2'e nükleofilik saldırısı gerçekleşmektedir. İkinci basamakta (Reaksiyon 3) ise çinkoya bağlı su molekülünün iyonlaşması ve protonun uzaklaştırılmasıyla aktif bölgenin tekrar oluşturulması olayları gerçekleşmektedir.
Zn2+-OH- + CO2 --> Zn2+ + HCO3- Reaksiyon 2
Zn2+ + H2O --> H+ + Zn2+-OH- Reaksiyon 3
Bu mekanizmada Reaksiyon 3 safhasının gerçekleşmesinde, protonun dış çözücü ortamına aktarılması için enzimin aktif bölgesindeki bir amino asit birimi proton taşıyıcı birim (PTB) olarak rol oynamaktadır. PTB aldığı protonu ortamdaki tampon (B) moleküllerine aktarmaktadır (Reaksiyon 4 ve 5).
PTB + Zn2+-H2O --> Zn2+-OH- + PTB-H+ Reaksiyon 4
PTB-H+ + B --> PTB + B-H+ Reaksiyon 5
Karbonik anhidraz II'nin katalizlediği enzimatik mekanizmada hız belirleyici basamak protonun aktif bölgeden uzaklaştırılması safhasıdır. Bu edenle aktif bölgedeki proton taşıma kapasitesine sahip amino asit birimleri aktivitede önemlidirler Aktivitede çinkonun dördüncü ligand pozisyonuna yakın bölgede bir hidrojen bağı alıcısının olması önemlidir.
Fonksiyonları
Karbonik anhidraz enzimi birçok fizyolojik olayda rol almaktadır. Bunlar arasında en önemlileri şöyle sıralanabilir:
1) Asit-baz dengesi
2) Kardiovasküler tonusun düzenlenmesi
3) Sindirim
4) Hücre bölümleri arasındaki iyon değişimi
5) Değişik enzimatik reaksiyonlar için gerekli bikarbonatın sağlanması
Enzim, hidrataz aktivitesi yanında esteraz aktivitesine de sahiptir, ancak fizyolojik açıdan hidrataz aktivitesi önemlidir. Bu sayede organizmanın asit – baz dengesinin düzenlenmesinde önemli rol üstlenir. Bu dengenin bozulduğu durumlarda, örneğin göz içi tansiyonunda, karbonik anhidraz enzim aktivitesine müdahale sıklıkla uygulanan bir tedavi yöntemidir. Bu açıdan karbonik anhidraz inhibitörleri klinik olarak önemli bileşiklerdir.[3]
Karbonik Anhidraz Araştırmalarında Uygulanan Yöntemler
Karbonik anhidraz izoenzimlerinin biyolojik numunelerden izole edilmesinde, saflaştırılmasında ve karakterizasyonunda birçok kromatografik ve elektroforetik yöntem uygulanmıştır. Karbonik anhidrazın farklı izoformlarının farklı canlılardan ve dokulardan kromatografik ayrılmasında, uygulanan yöntemde farklılık arz etmektedir.
Karbonik Anhidraz İzoenzimlerinin Kromatografik Ayrılması
Karbonik anhidrazın memeli türlerinden izolasyonunda kaynak ve izoenzime göre farklı yöntem uygulanmaktadır. Üzerinde en fazla çalışma yapılmış olan izoenzimler sitoplazmik karbonik anhidraz I ve karbonik anhidraz II dir. Bu iki izoenzimin en kolay elde edilebilir kaynağı eritrositlerdir. Yapılan çalışmalarda eritrositlerde fazla miktarda bulunan hemoglobin, kloroform – etanol çöktürmesi, amonyum sülfat çöktürmesi ya da ısı ile denatürasyon yöntemleriyle uzaklaştırılabilmiştir. Bunların yanında üç-faz ayrışma yöntemide bir alternatif olmuştur. Bu yöntemde amonyum sülfat gibi bir tuz tert-butanol – su – protein karışımına ilave edilmiş ve böylece hemoglobin ve miyoglobin denatüre edilerek ayrılabilmiştir. Daha sonra amonyum sülfatın %90 doygunluğa ulaştırılmasıyla kalan proteinler jelimsi orta fazda toplanmıştır. Bu fazda karbonik anhidrazın yanında katalaz ve süperoksit dismütaz da bulunur. Karbonik anhidraz I ve II'nin izolasyonunda en çok kullanılan yöntem afinite kromatografisidir. İlk defa 1970 lerde uygulanmaya başlamış olan bu yöntemle sonraları karbonik anhidraz I ve II izoenzimleri başarılı bir şekilde birbirinden ayrılabilmiştir. Bu yöntemlerde destek maddesi olan jele enzimin güçlü bir şekilde bağlandığı inhibitörleri takılmakta ve enzimin bu moleküller aracılığıyla kolonda tutulması sağlanmaktadır. Bu anlamda en çok kullanılan inhibitör de sülfanilamiddir.[4]
Mutasyon teknikleriyle hazırlanan inaktif karbonik anhidraz II'nin izolasyonunda inhibitörlerle bağlanmanın olmadığı durumlarda alternatif yöntemler uygulanmıştır. Önce %40 doygunlukta amonyum sülfat ile diğer safsızlıklar uzaklaştırılmış sonra %90 amonyum sülfat doygunluğunda insan karbonik anhidraz II çöktürülmüştür. Diyalizi takiben DEAE-Sephacel kolonundan geçirme ve sonra S-Sepharose ile kromatografi uygulanarak enzim %98 saflıkta elde edilmiştir. Bir grup araştırmacı da mutant enzim izolasyonunda S-Sepharose ile anyon değişimini, sonra fenil-Sepharose ile hidrofobik etkileşim kromatografisini ve son olarak da Sephacryl S-100 ile jel filtrasyonunu kullanmışlardır. Karbonik anhidraz III'ün afinite kromatografisinde kullanılan inhibitörlere bağlanmasının çok zayıf olmasından dolayı bu izoenzim önceleri farklı yöntemlerle izole edilmiştir. Sonraları bu izoenzimin p-aminobenzen sülfonamide yeteri derecede bağlandığı gösterilmiş ve bu inhibitör kullanılarak enzim afinite kromatografisi ile izole edilebilmiştir. Benzer şekilde membrana bağlı bir izoform olan karbonik anhidraz IV'te p-aminobenzen sülfonamid afinite kromatografisiyle izole edilmiştir.[5][6]
Mitokondriyel bir enzim olan karbonik anhidraz V izolasyonunda, mitokondrilerin bütün sitosolik bileşenlerden ayrılmasını takiben dondurucuda bekletilip santrifüjlenmesi ve elde edilen tamamen çözünür durumdaki mitokondriyel matriks, p-aminobenzen sülfonamidin CM Biogel A'ya takılmasıyla hazırlanmış jelin bulunduğu kolondan geçirilmiştir. Daha sonra enzim sodyum azidür (NaN) ile elue edilerek başarılı bir şekilde izole edilmiştir.[7]
Salgılanan bir enzim olan karbonik anhidraz VI, inhibitörlerle karbonik anhidraz II'ye benzer şekilde etkileşmektedir ve bu nedenle afinite kromatografisi izolasyon amacıyla rahatlıkla kullanılabilmiştir.[8]
Memeli izoenzimlerinin haricinde diğer karbonik anhidraz izoformları da özellikle p-aminobenzen sülfonamid kullanılarak afinite kromatografisiyle izole edilebilmektedir. Bu izoenzimlerin izolasyonunda birçok farklı yöntem de uygulanmıştır. Bunlar arasında Sephadex G-75 ile jel-permeasyon kromatografisi, CM-selüloz katyon değişimi kromatografisi, DEAE Sephadex A-50 anyon değişimi kromatografisi, DEAE-selüloz kromatografisi, DEAE-hidroksilapatit kromatografisi sayılabilir. Bu yöntemler tek başlarına değil genellikle birkaç tanesi ardışık olarak uygulanmıştır. Bu yöntemlerin uygulandığı çalışmalarda istenmeyen proteinlerden kurtulmak için birinci basamakta etanol-kloroform çöktürmesi sıklıkla uygulanmaktadır.[9]
Karbonik Anhidraz Çalışmalarında Elektroforetik Yöntemler
İzole edilen karbonik anhidraz izoenzimlerin tanınmasında ve saflığının kontrolünde elektroforetik yöntemler uygulanmaktadır. Çalışmanın amacına uygun olarak sodyum dodesil sülfat poliakrilamid jel elektroforezi (SDS-PAGE) ve normal (SDS'siz) PAGE en çok tercih edilen yöntemlerdir. SDS-PAGE'de enzim denatüre olduğu için enzimin doğal formda olması gerektiği çalışmalarda tercih edilmez. SDS-PAGE indirgeyen ve indirgemeyen tarzda iki şekilde uygulanabilmektedir. Bu da indirgenmenin olmasının istenmediği durumlarda önemli bir özelliktir. Karbonik anhidraz izoenzimlerinin karakterizasyonunda ayrıca diğer bazı yöntemler de mevcuttur. En çok kullanılanlar izoelektrik odaklama[10] ve afinite elektroforezidir (10). İzoelektrik odaklama enzimler üzerinde meydana gelebilecek ikincil modifikasyonların tespitinde önemli bir araçtır. Bu yöntem ayrıca S-tiyollenmenin belirlenmesinde başarılı bir şekilde kullanılmıştır (11). Afinite kromatografisinin elektroforezle birleştirilerek uygulandığı afinite elektroforezi ise daha çok inhibitörlerle yapılan kinetiğin ve denge sabitlerinin incelendiği çalışmalarda tercih edilmektedir.[11] Bu yöntemlerde inhibitör jele tutturularak elektroforez uygulanmakta ve alınan yola göre bağlanma sabitleri belirlenmektedir. Bu yöntemde jel ile inhibitör arasında en az 20 Ao'luk bir uzatıcı kolun bulunmasının maksimum bağlanma için gerekli olduğu bilinmektedir.[12]
Kaynakça
- ^ "Karbonik anhidraz". sciencedirect.com. 3 Ocak 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 9 Nisan 2012..(İngilizce)
- ^ "Tripp, B. C., Smith, K., Ferry, J. G.: Minireview: Carbonic anhydrase: New insights for an ancient enzyme. The Journal of Biological Chemistry, 276 (52): 48615-48618, 2001." 17 Mayıs 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Mart 2008.
- ^ Puscas, I., Puscas, C., Coltau, M., Baican, M., Domuta, G.: the serum of carcinoma patients powerfully activates carbonic anhydrase II. Experimental Oncology, 22: 162-164, September 2000.
- ^ Arslan, O., Nalbantoğlu, B., Demir, N., Özdemir, H., Küfrevioğlu, Ö. İ.: A new Method for the purification of carbonic anhydrase isozymes by affinity chromatography. Turkish Journal of Medical Sciences, 26: 163-166, 1996.[]
- ^ Backman, L. Binding of human carbonic anhydrase to human hemoglobin. Eur. J. Biochem., 120, 257-281, 1981.
- ^ Whitney, P.L. and Briggle, T.V. Membrane-associated carbonic anhydrase purified from bovine lung. J. Biol. Chem., 257, 12056-12059, 1982.[]
- ^ Storey, B.T., Dodgson, S.J. and Forster, R.E. Mitochondrial carbonic anhydrase: the purified enzyme. Ann. N.Y. Acad. Sci., 429, 210-211, 1984.
- ^ "Murakami, H. and Sly, W.S. Purification and characterization of human salivary carbonic anhydrase. J. Biol. Chem., 262, 1382-1388, 1987." 23 Nisan 2008 tarihinde kaynağından arşivlendi. Erişim tarihi: 10 Mart 2008.
- ^ Vince, J.W. and Reithmeier, R. A. F.: Identification of the carbonic anhydrase II binding site in the Cl-/HCO3-anion exchanger AE1. Biochemistry, 39: 5527-5533, 2000.
- ^ Brady, H.J., Edwards, M., Linch, D.C., Knott, L., Barlow, J.H. and Butterworth, P.H. Expression of the human carbonic anhydrase I gene is activated late in fetal erythroid development and regulated by stage-specific trans-acting factors. Br. J. Haematol., 76, 135-142, 1985.
- ^ Chu, Y.H., Chen, J.K. and Whitesides, G.M. Affinity electrophoresis in multisectional polyacrylamide slab gels is a useful and convenient technique for measuring binding constants of aryl sulfonamides to bovine carbonic anhydrase B. Anal. Chem., 65, 1314-1322, 1993.
- ^ Lii, C.K., Chai, Y.C., Zhao, W., Thomas, J.A. and Hendrich, S. S-thiolation and irreversible oxidation of sulfhydryls on carbonic anhydrase III during oxidative stress: a method for studying protein modification in intact cells and tissues. Arch. Biochem. Biophys., 308, 231-239, 1994.