
Kömür, katmanlı tortul çökellerin arasında bulunan katı, koyu renkli, karbon ve yanıcı gazlar bakımından zengin kayaçtır. Taşkömürü torkugillerden oluşur. Kömür çoğunlukla diğer elementlerin değişken miktarlarda bulunmasıyla oluşur. Asıl bileşeni karbondur; bunun yanında değişken miktarda hidrojen, kükürt, oksijen ve azot içerir. Isı için yakılan bir fosil yakıt olan kömür dünyanın birincil enerjisinin yaklaşık dörtte birini ve elektriğinin beşte ikisini sağlar. Bazı demir ve çelik üretimi yapan işletmeler ve diğer endüstriyel faaliyetler kömürü yakar. Kömürün ekstraksiyonu ve kullanımı birçok erken ölüme ve çok fazla hastalığa neden olur. Kömür'den her yıl binlerce kişi erken ölüyor.

Karbon, doğada yaygın bulunan ametal kimyasal elementtir. Evrende bolluk bakımından altıncı sırada yer alan karbon, kızgın yıldızlarda hidrojenin termonükleer yanmasında temel rol oynar. Dünyada hem doğal halde, hem de başka elementlerle bileşik halinde bulunan karbon, ağırlık olarak Dünya'nın yerkabuğunun yaklaşık %0,2'sini oluşturur. En arı (katışıksız) biçimleri elmas ve grafittir; daha düşük arılık derecelerinde maden kömürünün, kok kömürünün ve odun kömürünün bileşeni olarak bulunur. Atmosferin yaklaşık % 0,05'ini oluşturan ve bütün doğal sularda erimiş olarak bulunan karbon dioksit, kireç taşı ve mermer gibi karbonat mineralleri, kömürün, petrolün ve doğalgazın başlıca yapıtaşları olan hidrokarbonlar, en bol bulunan bileşikleridir.

Kükürt, simgesi S, atom numarası 16 olan, limon sarısında ametal, yalın katı bir elementtir.

Demir, simgesi Fe ve atom numarası 26 olan kimyasal bir elementtir.

Karbonmonoksit, CO formülüne sahip sadece bir karbon ve bir oksijen atomundan oluşan inorganik bileşiktir Karbonmonoksitte karbon ve oksijen arasında üçlü bağ vardır. Endüstride jeneratör gazı, su gazı, kuvvet gazı ve hava gazı içinde kullanılır. Yakıt olarak da kullanılmaktadır.

Karbondioksit, kovalent bağlı bir karbon ve iki oksijen atomundan oluşan moleküle sahip, normal koşullarda gaz hâlinde bulunan bileşiğin adıdır. Renk ve kokusu yoktur. Kimyasal formülü CO2 şeklinde olup molekül ağırlığı 44,009 g/mol'dür. Karbon içeren besin maddelerinin metabolize edilmesi sonucu meydana gelen bir son üründür. Küresel ısınmada önemli bir pay sahibidir. Yerden yansıyan güneş ışınlarının atmosferden çıkma oranını azaltır.

Michael Faraday, elektromanyetizma ve elektrokimyaya katkılarıyla tanınan, İngiliz kimya ve fizik bilgini.
Kloroform veya triklorometan, CHCl
3 formülüne sahip bir organik bileşiktir. Oda sıcaklığında kolay buharlaşan, hoş kokulu, renksiz, yanıcı olmayan ağır bir sıvıdır. Çözücü olarak sıkça kullanılır. PTFE (Teflon) ve bazı soğutucuların üretiminde kullanılmak için bol miktarlarda üretilir.

İyot, sembolü I, atom numarası 53 olan bir elementtir. Kimyasal olarak iyot halojenlerin en az reaktif olanı, astatin'den sonra en elektropozitif olanıdır. İyot başlıca tıpta, fotoğrafçılıkta ve boya imalatında kullanılır. Çoğu canlının eser miktarda iyota gereksinimi vardır.

Formaldehit CH2O formülüne sahip bir organik bileşiktir. Aldehitlerin en basit üyesidir, diğer ismi Metanaldir. Karbonil grubunun boş olan iki bağına birer hidrojen bağlanmasıyla oluşur. Tüm gelişmiş canlılarda doğal olarak üretilir. Zehirli bir gazdır. Sulu çözeltisinin kendisine özgü, yakan bir kokusu vardır. Formaldehit, genellikle %37'lik sulu çözeltisi şeklinde taşınır veya depo edilir. Bu çözeltiye formalin denir. Formalinden, düşük basınç altında su buharlaşıp, ayrıldığı zaman, paraformaldehit meydana gelir. Bu bir polimer olup, formülü HO(CH2O)xH olan beyaz katı bir maddedir (x yaklaşık 30'dur). Bu polimer ısıtıldığı zaman, gaz formaldehite dönüşür. Bundan dolayı, gaz formaldehit elde etmek için, uygun bir kaynaktır. Saf formaldehitten, polimer ürünler elde edilebildiği gibi, fenol ve kazein ile de sentetik reçine ve plastikler imal edilmektedir.

Kısaca vinil eter olarak bilinen divinil eter, (CH=CH
2)
2O formülüne sahip doymamış, simetrik bir eterdir. Kaynama noktası düşük, yüksek uçuculuğa sahip ve aşırı yanıcı bu sıvı geçmişte narkoz araştırmalarının odağı olmuştur. Anestezik özellikleri diğer bir simetrik eter olan dietil etere benzer. Özellikle kısa süreli ameliyatlarda ve diş cerrahisinde kullanıldı.

Kuru temizleme, kumaşların üzerinde bulunan kir ve lekeleri çıkarmak için su içermeyen apolar bir çözücü kullanılarak yapılan yıkama işlemidir. Dünya çapında genel olarak kuru temizlemede tetrakloroetilen isimli toksisitesi düşük ve yanıcı olmayan bir sıvı kullanılır. Yapısı polar olan su kullanan ıslak temizlemeden farklıdır, yine de sıvı içerir, ancak giysiler bunun yerine su içermeyen bir sıvıyla yıkanır.

Diklorometan (DCM) ya da metilen klorür CH2Cl2 formülüne sahip bir organik bileşiktir. Renksiz, uçucu bir sıvıdır ve hoş kokuludur. Su ile karışmasa da biraz polardır ve birçok organik çözücüde çözünür. Çözücü olarak kullanılır.

Karbon tetraklorür ya da tetraklorometan, CCl4 formülüne sahip bir klorokarbon. Kokusu Kloroforma benzeyen, renksiz, yanıcı olmayan, sudan ağır bir sıvıdır. Suda çözünmezken birçok organik çözücü içinde çözünür. Geçmişte soğutucu gazların üretiminde, yangın söndürücülerde lav lambalarında, temizlik malzemesi ve kurt düşürücü olarak yaygın bir şekilde kullanılmıştır.
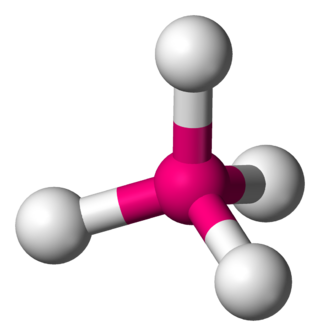
Dörtyüzlü veya tetrahedral molekül geometrisi, merkezi atomun, dört yüzlünün ortasında, dört köşede ise sübstitüentlerin yer aldığı molekül geometrisidir. Bağ açıları, dört sübstitüent aynı olduğunda (örn. metan CH4 ya da daha ağır analogları) cos−1 (-⅓) = 109,4712206 ...° ≈ 109.5° olur. Metan veya diğer simetrik yüzlü moleküller Td nokta grubuna aittir, ama dörtyüzlü moleküller genellikle düşük simetriye sahiptir. Tetrahedral moleküller kiral olabilir.

Klorometan ya da metil klorür, CH3Cl formülüne sahip bir alkil halojenürdür. Aşırı derecede yanıcı bir gazdır. Önceden soğutucularda kullanılmıştır ancak toksisitesinden dolayı artık tüketici ürünlerinde kullanılmamaktadır. Klorometan ilk olarak Jean-Baptiste Dumas ve Eugene Peligot isimli iki Fransız kimyager tarafından 1835'te metanol, sülfürik asit ve sodyum klorür karışımının kaynatılması ile sentezlenmiştir, bu yöntem günümüzde kullanılana çok benzerdir.
Disülfür diklorür S
2Cl
2 formüllü kükürt ve Klor bileşiğidir.

Adolph Wilhelm Hermann Kolbe modern organik kimyanın doğuşuna büyük katkıda bulunan kimyagerlerden biridir ve Marburg ve Leipzig'de profesörlük yapmıştır. Sentez terimini kimyasal bağlamda ilk uygulayan Kolbe oldu ve organik madde asetik asidin karbon disülfürden sentezi yoluyla vitalizmin felsefi ölümüne katkıda ve aynı zamanda yapısal teorinin gelişmesine de katkıda bulundu. Bu, "radikaller" fikrinde yapılan değişiklikler, ikincil ve üçüncül alkollerin varlığının doğru tahmin edilmesi ve karboksilat tuzlarının Kolbe elektrolizi, aspirin hazırlanmasındaki Kolbe-Schmitt reaksiyonu ve Kömbe nitrik sentezi aracılığıyla ortaya çıkan organik reaksiyon dizisi yoluyla yapılmıştı. Wöhler ve Bunsen ile yaptığı çalışmalardan sonra Kolbe, Londra'da çalışarak kimyanın erken uluslararasılaşmasına dahil oldu.

Adını Octave Leopold Boudouard'dan alan Boudouard reaksiyonu, belirli bir sıcaklıkta karbon monoksit ve karbon dioksitin kimyasal denge karışımının redoks reaksiyonudur. Karbon monoksitin karbondioksit ve grafite orantısız hale gelmesi veya bunun tersidir:
- 2CO
 CO2 + C
CO2 + C

Perklorometil merkaptan, CCl3SCl formülüne sahip organosülfür bileşiğidir. Esas olarak boyalar ve fungisitlerin (captan, folpet) üretiminde bir ara madde olarak kullanılır. Ticari numunelersarımsı renkte olmasına rağmen saf bileşik renksiz bir yağdır. Suda çözünmez fakat organik çözücülerde çözünür. Kötü, dayanılmaz, keskin bir kokusu vardır. Perklorometil merkaptan orijinal adıdır, sistematik adı triklorometansülfenil klorür olmalıdır çünkü bileşik bir merkaptan değil, bir sülfenil klorürdür.


















