
Porfirin, dört metiliden (-CH=) köprüsüyle birbirine bağlı dört pirol halkasından ibaret olan porfin halka sistemi ihtiva eden molekül sistemidir. Bu molekül inorganik yapının organik yani canlı yaşamına nasıl evrildiğinin anlaşılmasını da sağlamıştır. Yani dünyadaki yaşam cansızdan canlıya bu madde ile geçmiştir. Doğada genellikle I ve III numaralı porfirin şekli bulunur. Porfirinlerdeki yan grupların dizilimi simetrik olduğu takdirde Tip I; asimetrik olduğu takdirde Tip III izomerleri oluşur. Tip III izomerleri en fazla bulunan ve önemli olan tiptir.

Lipit, tüm canlıların yapısında bulunan temel organik bileşiklerden biridir. Lipitler, doymuş ve doymamış yağlar olarak ayrılır. Doymamış yağlar, oda sıcaklığında sıvı hâlde bulunan lipitler; doymuş yağlar ise oda sıcaklığında katı hâlde bulunan lipitlerdir. Biyolojik önemi olan lipitler için yağ asitleri, nötr lipitler (trigliserit), fosfolipitler ve steroitler örnek gösterilebilir. Lipitler, insan ve hayvanların temel besinleri arasında yer alır.

Tuz, kimyada, bir asitle bir bazın tepkimeye girmesi neticesinde meydana gelen maddedir. Tuz, asitteki eksi yüklü iyonla (anyon) bazdaki artı yüklü iyondan (katyon) meydana gelir. Asitle baz arasındaki nötralleşme tepkimesi esnasında tuz ve su açığa çıkar. Erimiş tuz veya çözelti halindeki tuzların çoğu eksi ile artı yüklü iyonlarına ayrışır ve elektriği iletir. Tuz adı ayrıca sofra tuzu veya sodyum klorür (NaCl) için de kullanılır.

Molekül, birbirine bağlı gruplar halindeki atomların oluşturduğu kimyasal bileşiklerin en küçük temel yapısına verilen addır. Diğer bir ifadeyle bir molekül bir bileşiği oluşturan atomların eşit oranlarda bulunduğu en küçük birimdir. Moleküller yapılarında birden fazla atom içerirler. Bir molekül aynı iki atomun bağlanması sonucu ya da farklı sayılarda farklı atomların bağlanması sonucunda oluşabilirler. Bir su molekülü 3 atomdan oluşur; iki hidrojen ve bir oksijen. Bir hidrojen peroksit molekülü iki hidrojen ve 2 oksijen atomundan oluşur. Diğer taraftan bir kan proteini olan gamma globulin 1996 sayıda atomdan oluşmakla birlikte sadece 4 çeşit farklı atom içerir; hidrojen, karbon, oksijen ve nitrojen. Molekülleri oluşturan kimyasal bağlara Moleküler bağlar denir. Bunlar kovalent, iyonik ve metalik bağlardır.

İyon ya da yerdeş, bir veya daha çok elektron kazanmış ya da yitirmiş bir atomdan oluşmuş elektrik yüklü parçacıktır. Atomlar kararsız yapılarından kurtulmak ve kararlı hale gelebilmek için elektron alırlar ya da kaybederler. Bunun için de başka bir atomla ya da kökle bağ kurarlar.
Klorür, nötr hâldeki klor atomunun, bir elektron alarak iyon (anyon) hâline geçtiğinde aldığı isim. Cl− olarak gösterilir. Klorür iyonu içeren maddelere de verilen bir isimdir. Bir iyon olduğundan dolayı, kendi başına doğada yer almaz; ancak bir çözeltide karşı iyonu ile yer alabilir.

Silikat, mineral grupları arasında en geniş gruptur.

İyonik bağ, zıt yüklü iyonlar arasındaki elektrostatik kuvvetlere dayanan bir kimyasal bağ türüdür.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.

Kimyada esterler, bir hidroksil grubundaki hidrojen atomunun bir organik grup (bu metinde R' olarak gösterilecektir) ile yer değiştirmiş olduğu organik bileşiklerdir. Hidrojenin bir H+ iyonu olarak ayrışabileceği -OH grubu olan bu tür asitlere oksijen asidi denir.
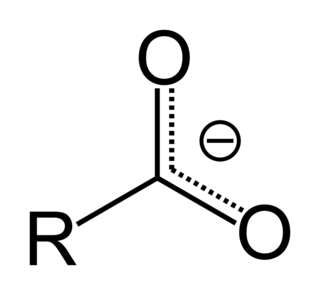
Karboksilat karboksilik asitin bir tuzu veya esteri. Karboksilat tuzlar, M'in bir metal ve n 'in 1, 2, .... gibi sayıları ifade ettiği, M(RCOO)n genel formülü ile ifade edilir. Karboksilat esterler RCOOR′ genel formülüne sahiptir. R ve R′ organik gruplardır; R′ ≠ H.
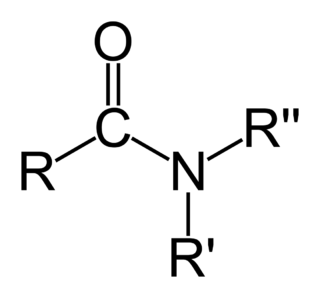
Kimyada amid sözcüğü iki anlama sahiptir: - Birinci anlamıyla amid, bir azot atomuna (N) bağlı bir karbonil grubu bulunduran bir organik fonksiyonel grup veya bu gruba sahip bir bileşiktir. - İkinci anlamıyla amid, bir azot anyonudur.
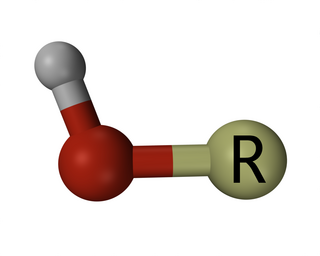
Hidroksil molekülü, kovalent bağ ile bağlanmış hidrojen (H) ve oksijen (O) atomlarından oluşur. Gösterilişi OH- şeklindedir.

Sülfat iyonu, inorganik kimyada bir sülfür atomu ile bunu tetrahedral yapıda çevreleyen dört eş oksijen atomundan oluşan, negatif yüklü bir anyondur. Ampirik formülü SO42- ve moleküler ağırlığı 96,06 daltondur. Hidrojenle birleştiğinde sülfürik asit oluşturur. Ayrıca,Dimetil sülfat gibi organik sülfatlar, kovalent bileşiklerdir ve sülfürik asidin esterleridir.
- Sülfürik asitte metalin eritilmesi
- Sülfürik asidin bir metal hidroksit veya oksit ile reaksiyonu
- Metal sülfür veya sülfitlerin oksidasyonu
Esterlerin su alarak alkol ve asitlere ayrışması reaksiyonudur. Sabunlaşma esterleşmenin tersi olan bir reaksiyondur.Sabunlaşma denilince esterlerin Hidrolizi akla gelmektedir. Bu tepkimenin gerçekleşmesi için hidroksitlerin sulu çözeltisi daha doğru Natriıum hidroksit ya da esterleri parçalaya bilen özel enzimler gerekmektedir. Bitkisel ya da hayvansal yağların sabunlaşması sonucu üç değerli bir alkol olan Gliserin ile yağ asidi oluşur. Sabunlaşma sodyum hidroksit ya da potasyum hidroksit ile yapılırsa yağ asidi yerine bunun sodyum tuzu ya da potasyum tuzu elde edilir. Sabunlaşma temelde bir çeşit Hidroliz reaksiyonudur.

Okyanus asitlenmesi, okyanusların atmosferden antropojenik karbondioksit emmesi sebebiyle pH'ının düşmesi yani asitlenmesidir.

Ayrışma, çözünme veya günlenme, yerkabuğunu oluşturan kayaçların yüzey kısımlarında fiziksel ve kimyasal etkenlerle meydana gelen değişimlerdir. Bu etkenlerin yanında atmosferdeki gazlar, sıcaklık, su, organizmalar da ayrışmada etkilidir.
Metabolik alkaloz, dokudaki pH'ın normal aralığın (7,35-7,45) üstüne çıkması ile ortaya çıkan metabolik durumdur. Bu hidrojen iyonu yoğunluğunun artmasıyla yükselen karbonat artışı veya doğrudan karbonat yoğunluğunun artmasının bir sonucudur.
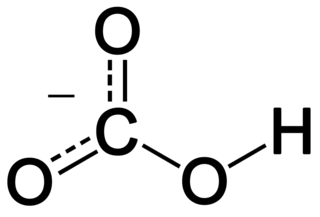
Bikarbonat, inorganik kimyada, (IUPAC-önerilen isim: hidrojen karbonat) karbonik asitin protonsuzlaştırılmasındaki bir ara yapı. HCO3− kimyasal formülene sahip moleküler iyondur.

İyodik asit, HIO3, beyaz veya kirli beyaz bir katı madde olarak elde edilebilir. Suda çok iyi çözünür, ancak klorik asit veya bromik asidin aksine saf halde bulunur. İyodik asit +5 oksidasyon durumunda iyot içerir ve halojenlerin saf halde en stabil okso-asitlerinden biridir. İyot asidi dikkatle ısıtıldığında pentoksit iyice dehidre olur. Daha sonraki ısıtmada, iyot pentoksit ayrıca iyot, oksijen ve düşük iyot oksitleri karışımı vererek ayrışır.
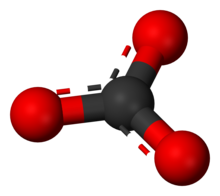
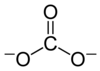
 Chisholm, Hugh, (Ed.) (1911). "Carbonates". Encyclopædia Britannica (11. bas.). Cambridge University Press.
Chisholm, Hugh, (Ed.) (1911). "Carbonates". Encyclopædia Britannica (11. bas.). Cambridge University Press.















