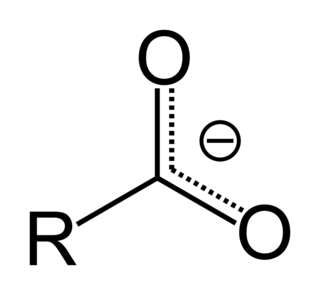
Karboksilik asit



Karboksilik asitler karboksil grubu olan organik asitlerdir, -C(=O)OH formülüne sahiptirler, bu genelde -COOH veya CO2H olarak da yazılır.[1] Karboksilik asitler Bronsted asitleridir, yani proton vericileridir. Karboksilik asitlerin tuz ve anyonlarına karboksilat denir. Karboksilik asitler, esterlerle fonsiyonel grup izomeridirler. Karboksilik asitlerin en basit dizisi alkanoik asitlerdir, R-COOH formülüyle gösterilirler, R bir hidrojen atomu veya bir alkil grubuna karşılık gelir. Bileşiklerde birden fazla karboksilik asit grubu bulunabilir.
Fiziksel özellikler

Karboksilik asitler polar moleküllerdir ve birbirleriyle hidrojen bağları kurarlar. Yüksek sıcaklıkta, buhar fazında, karboksilik asit molekülleri çiftler (dimer) halinde bulunurlar. Kısa karboksilik asitler (1-4 karbonlu) suda çözürler, daha uzun olanları ise alkil zincirin gittikçe artan hidrofobik özelliği yüzünden çok daha az çözünürler. Eter ve alkol türü daha az polar çözücülerde çözünme eğilimleri vardır.[2]
Karboksilik asitler tipik olarak zayıf asitlerdir, yani sadece kısmen H+ katyonu ve RCOO− anyonlarına ayrışırlar. Örneğin, oda sıcaklığında suda çözünmüş asetik asit molekülerinin yalnızca % 0.02 ayrışmış durumdadır.
Karboksilik asitler zayıf asitler olduklarından suda her iki biçimleri arasında bir denge oluşur:
- RCOOH ↔ RCOO- + H+
Karboksilik asitlerin asitlikleri hem asit halin, hem de eşlenik (konjüge) bazın kararlılığı ile açıklanabilir.
Asidin kararlılığı
Karboksilik asitlerin asitliği, iki elektronegatif oksijen atomunun O-H bağını çevreleyen elektron bulutunun şeklini bozarak bu bağı zayıflatması ile, endüktif etkiler ile açıklanabilir. Zayıf O-H bağı asit molekülünün daha az kararlı olmasına neden olur ve hidrojen atomunun daha kolay ayrışıp H+ iyonu salmasına neden olur. Asit karasız olduğu için denge sağa kaymış durumdadır.
Ek elektronegatif atom veya grupların, R grubu üzerinde bulunana klor veya hidroksil gibi, benzer ama daha zayıf etkileri olur. Bu grupların varlığı endüktif etki sonucu asitliği artırır. Örneğin (üç -Cl grubu olan) trikloroasetik asit, laktik asitten (bir -OH grubu olan)daha kuvvetli bir asittir, o da asetik asitten (hiç elektronegatif parçası olmayan) daha kuvvetlidir.
Spektroskopi
Karboksilik asitler kızıl ötesi spektroskopisi ile kolaylıkla tanınabilirler. 1680 ile 1725 cm−1 arasında keskin bir C=O gerilmesi vardır, ayrıca karboksil grubununun kendine has O-H gerilmesi 2500 ile 3000 cm−1 arasında yayvan bir tepe olak belirir.[2]
1H NMR spektrometresinde hidroksil hidrojeni 10-13 ppm bölgesinde görünür, ama eser miktarda su ile değişim yüzünden ya genişlemiş olur ya da hiç gözlemlenmez.
Kaynakça
Kısa düz zincirli alifatik karboksilik asitler ve C18'e kadar uzunluktaki çift sayılı karbonlular ticarî olarak sağlanabilir. Örneğin, asetik asit karbon monoksitin metanol karbonilasyonu ile üretilir. Daha uzun karboksilik asitler ise bitki veya hayvan kaynaklı trigliseritlerin hidrolizinden elde edilir.
Sirke, asetik asidin derişik bir çözeltisidir, biyolojik olarak, etanolun fermantasyonu yoluyla üretilir.
Sentez
Karboksilik asitler birincil alkol ve aldehitlerin, Jones ayracı, potasyum permanganat veya sodyum klorit gibi kuvvetli yükselgenlerle yükseltgenmesi ile üretilebilir. Ayrıca olefinlerin potasyum permanganat veya potasyum dikromat ile oksidatif parçalanması yoluyla da üretilebilirler. Özellikle bir benzen halkasındaki herhangi bir alkil grubu, zincir uzunluğu her ne olursa olsun, bir karboksilik aside tamamen yükseltgenir. Benzoik asidin endüstriyel olarak toluenden sentezlenme yöntemi buna dayalıdır.
Karboksilik asitler ayrıca, asit veya baz eklenerek, nitrillerin, esterlerin veya amidlerin hidrolizi ile de elde edilebilirler. Ayrıca karbon dioksit üzerine etki edecek bir Grignard ayracı ile de hazırlanabilirler, ama bu yöntem endüstride kullanılmaz.
Karboksilik asitler asağıdaki tepkimelerle de oluşabilirler:
- Bir aldehitin Cannizaro tepkimesi ile disproporsiyonu
- Diketonların benzilik asit düzenlenmesi ile düzenlenmesi
- Haloform tepkimesinde metil ketonların halojenasyon ve ardından hidrolizi ile
- Benzoik asitlerin oluşumunda yer alan daha ender bazı tepkimeler, nitrobenzenlerden von Richter tepkimesi ve fenollerden Kolbe-Schmitt tepkimesidir.
Tepkimeler
Karboksilik asitler bazlar ile tepkiyip karboksilat tuzları oluştururlar, hidroksildeki hidrojen bir metal katyonu ile yer değiştirir. Böylece, örneğin sirkede bulunan asetik asit, sodyum bikarbonat ile reaksiyona girip sodyum asetat, karbon dioksit ve su oluşturur:
- CH3COOH + NaHCO3 → CH3COONa + CO2 + H2O
Karboksilik asitler alkol ve aminlerle tepkiyip ester ve amidler oluştururlar. Diğer alkol ve fenoller gibi karboksilik asitlerdeki hidroksil de, tionil klorür kullanılarak klor atomuyla yer değiştirip asil klorürler oluşturabilir.
Karboksilik asitler lityum aluminyum hidrit veya boran ile indirgenip birincil alkoller oluşturabilirler ancak bu tepkimelerden birincisi yavaştır. Esterler daha kolay indirgenebilirler, bu yüzden asitlerin indirgenmeden evvel esterleştirilmesi genelde daha mümkündür.
Tüm karbonil bileşikler gibi α-karbondaki protonlar da keto-enol totomerizasyonu ile ayrılmaya müsaittir. Böylece, Hell-Volhard-Zelinsky halojenasyonu ile alfa karbon kolayca halojenleşebilir.
- Arndt-Eistert sentezi karboksilik aside bir α-metilen grubu dahil eder.
- Curtius düzenlemesi karboksilik asitleri isosiyanatlara dönüştürür.
- Karboksilik asitler Hunsdiecker tepkimesi ile dekarboksile olurlar.
- Dakin-West tepkimesi bir amino asidi ona karşılık gelen amino ketona dönüştürür.
- Barbier-Wieland bozunumunda alifatik karboksilik asidin alfa metilen grububir dizi adımla ayrılır, böylece sincir kısalması meydan gelir.[3][4]
- Bir bileşiğe bir karboksilik grubun eklenmesine karboksilasyon denir; onun çıkartılmasına da dekarboksilasyon. Bu tepkimeleri katalizleyen enzimlere karboksilaz (EC 6.4.1) ve dekarboksilaz (EC 4.1.1) denir.
Adlandırma ve örnekler
Karboksilat anyonu R-COO- genelde -at eki ile adlandırılır, dolayısıyla, örneğin, asetik asitinin iyonuna asetat denir. IUPAC adlandırma sisteminde karboksilik asitlerin -oik asit eki olur (örneğin oktadekanoik asit). Genel kullanımda ek genelde -ik asit şeklindedir (örneğin stearik asit).
Bazı karboksilik asit sınıflarının temsilcileri aşağıda listelenmiştir:
- Kısa zincirli doymuş asitler
- Formik asit (metanoik asit) - HCOOH, arı ve karınca sokmalarında bulunur
- Asetik asit – CH3COOH, sirkede bulunur
- Propionik asit (propanoik asit) – CH3CH2COOH
- Orta zincirli doymuş monokarboksilik asitler
- Valerik asit (pentanoic acid) – C5H11COOH
- Enantik asit (heptanoic acid) – C6H13COOH
- Pargonik asit (nonanoic acid) – C8H17COOH
- Kısa zincirli doymamış monokarboksilik asitler
- Akrilik asit (2-propenoic acid) – CH2=CHCOOH, polymer sentezinde kullanılır
- Yağ asitleri– orta ve uzun alkan zincirli, bir karboksil gruplu asitler.
- Butirik asit (butanoic acid) – CH3CH2CH2COOH, ekşimiş terayağında bulunur
- Laurik asit (dodecanoic acid) – CH3(CH2)10COOH, hindistan cevizinde bulunur
- Dokoheksanoik asit
- Eikosapentanoik asit
- Amino asitler– proteinlerin yapı taşları
- Keto asitler– keton grubu taşırlar
- Pirüvik asit
- Asetoasetik asit
- Aromatik karboksilik asitler
- Benzoik asit– C6H5COOH. Sodyum benzoat, benzoik asidin sodyum tuzu, gıda koruyucusu olarak kullanılır
- Salisilik asit– çoğu deri bakım ürününde kullanılır
- Dikarboksilik asitler - iki karboksilik grubu vardır
- Aldarik asit - şeker asitleri ailesi
- Oksalik asit - çoğu gıdada bulunur
- Malonik asit
- Malik asit - elmalarda bulunur
- Suksinik asit - sitrik asit döngüsünün bir parçası
- Glutarik asit
- Adipik asit - naylon üretmekte kullanılan monmer
- Trikarboksilik asit - üç karboksil grubu vardır
- Sitrik asit - turunçgillerde bulunur
- Alfa hidroksi asitler - hidroksi grubu vardır
- Laktik asit (2-hidroksipropanoik asit) – ekşi sütte bulunur
Yaygın karboksilik asitler
| Adı | Doğal kaynağı | Kullanıldığı yerler |
|---|---|---|
| Formik asit | Karınca | Polimer sentezi |
| Asetik asit | Sirke | Boya ve tekstil endüstrisi |
| Propiyonik asit | Süt | Polimer sentezi |
| Bütirik asit | Tereyağı | Gıda ve parfüm maddesi |
| Valerik asit | Kediotu kökü | Gıda katkı maddesi |
| Palmitik asit | Palmiye çekirdeği | Yağların saklanması |
| Laurik asit | Hindistan cevizi yağı | Laboratuvar tetkikleri |
| Miristik asit | Hindistan cevizi yağ | Kozmetik tıbbi krem |
| Stearik asit | Hayvanlar ve bitkiler | Yüzey aktif madde üretimi |
| Oleik asit | Hayvansal ve bitkisel yağlar | Sabun ve cila yapımı |
| Oksalik asit | Kuzukulağı, kuşkonmaz | Tekstil boyama |
| Malik asit | Elma | Gıda endüstrisi |
| Tartarik asit | Bitkiler | Yün boyama |
| Sitrik asit | Limon | Metal temizleme,gıda koruyucu katkı maddesi |
| Adipik asit | Şeker pancarı özü | Yapay reçine ve strafor üretimi |
Ayrıca bakınız
Notlar
- ^ Compendium of Chemical Terminology, carboxylic acids 25 Aralık 2006 tarihinde Wayback Machine sitesinde arşivlendi., 15.01.2007 erisildi.
- ^ a b R.T. Morrison, R.N. Boyd. Organic Chemistry, 6th Ed. (1992) ISBN 0-13-643669-2.
- ^ Organic Syntheses, Coll. Vol. 3, p.234 (1955); Vol. 24, p.38 (1944) Link 27 Eylül 2007 tarihinde Wayback Machine sitesinde arşivlendi.
- ^ Organic Syntheses, Coll. Vol. 3, p.237 (1955); Vol. 24, p.41 (1944) Link 27 Eylül 2007 tarihinde Wayback Machine sitesinde arşivlendi..