
Atom veya ögecik, bilinen evrendeki tüm maddenin kimyasal ve fiziksel niteliklerini taşıyan en küçük yapı taşıdır. Atom Yunancada "bölünemez" anlamına gelen "atomos"tan türemiştir. Atomus sözcüğünü ortaya atan ilk kişi MÖ 440'lı yıllarda yaşamış Demokritos'tur. Gözle görülmesi imkânsız, çok küçük bir parçacıktır ve sadece taramalı tünelleme mikroskobu vb. ile incelenebilir. Bir atomda, çekirdeği saran negatif yüklü bir elektron bulutu vardır. Çekirdek ise pozitif yüklü protonlar ve yüksüz nötronlardan oluşur. Atomdaki proton sayısı elektron sayısına eşit olduğunda atom elektriksel olarak yüksüzdür. Elektron ve proton sayıları eşit değilse bu parçacık iyon olarak adlandırılır. İyonlar oldukça kararsız yapılardır ve yüksek enerjilerinden kurtulmak için ortamdaki başka iyon ve atomlarla etkileşime girerler.

Amino asitler, proteinleri oluşturan temel yapı taşlarıdır.
Hidroliz işlemi suyu oluşturan hidrojen ve oksijen elementlerinin birbirinden ayrılması ile sonuçlanan bir işlemdir. Bazı kaynaklarda hidroliz, moleküllerin su ilavesiyle daha fazla sayıda parçacık oluşturması olarak da geçer. Hidroliz, su ile bir kimyasal bağın parçalanmasıdır yani bir kimyasal reaksiyondur. Hidroliz genel olarak suyun nükleofil olduğu ikame(yer değiştirme reaksiyonu), eliminasyon(organik reaksiyon türü) ve solvasyon (çözme) reaksiyonları için kullanılır.

İyon ya da yerdeş, bir veya daha çok elektron kazanmış ya da yitirmiş bir atomdan oluşmuş elektrik yüklü parçacıktır. Atomlar kararsız yapılarından kurtulmak ve kararlı hale gelebilmek için elektron alırlar ya da kaybederler. Bunun için de başka bir atomla ya da kökle bağ kurarlar.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.
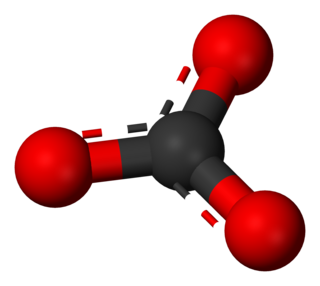
Karbonat, kimyada karbonik asidin bir tuzudur. Karbonat iyonu CO32- varlığında nitelendirilir. Aynı zamanda ismi karbonik asidin esteri manasına da gelebilir.

Karboksilik asitler karboksil grubu olan organik asitlerdir, -C(=O)OH formülüne sahiptirler, bu genelde -COOH veya CO2H olarak da yazılır. Karboksilik asitler Bronsted asitleridir, yani proton vericileridir. Karboksilik asitlerin tuz ve anyonlarına karboksilat denir. Karboksilik asitler, esterlerle fonsiyonel grup izomeridirler. Karboksilik asitlerin en basit dizisi alkanoik asitlerdir, R-COOH formülüyle gösterilirler, R bir hidrojen atomu veya bir alkil grubuna karşılık gelir. Bileşiklerde birden fazla karboksilik asit grubu bulunabilir.

Kimyada esterler, bir hidroksil grubundaki hidrojen atomunun bir organik grup (bu metinde R' olarak gösterilecektir) ile yer değiştirmiş olduğu organik bileşiklerdir. Hidrojenin bir H+ iyonu olarak ayrışabileceği -OH grubu olan bu tür asitlere oksijen asidi denir.
Dikarboksilik asitler, iki karboksilik asit fonksiyonel grubu ile ornatılmış organik bileşiklerdir. Dikarboksilik asit için moleküler formüllerde bu gruplar çoğu zaman HOOC-R-COOH olarak yazılır, burada R genelde bir alkil, alkenil veya alkinil gruptur. Dikarboksilik asitler naylon ve polietilen tereftalat gibi kopolimerler hazırlamak için kullanılırlar.

Kimyada amid sözcüğü iki anlama sahiptir: - Birinci anlamıyla amid, bir azot atomuna (N) bağlı bir karbonil grubu bulunduran bir organik fonksiyonel grup veya bu gruba sahip bir bileşiktir. - İkinci anlamıyla amid, bir azot anyonudur.

Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş organik bileşikler ve fonksiyonel gruplardır. Yapısal olarak aminler amonyağa benzerler, ama bir veya daha fazla hidrojen atomu, alkil veya aril gibi organik sübstitüentlerle yer değiştirmiştir. Bu kuralın önemli bir istisnası RC(O)NR2 tipi bileşiklerdir (C(O) karbonil grubuna karşılık gelir), bunlara amin yerine amid denir. Amidler ve aminlerin yapıları ve özellikleri farklı olduğu için bu ayrım kimyasal olarak önemlidir. Adlandırma açısında biraz akıl karıştırıcı olan bir nokta, bir aminin N-H grubunun N-M (M= metal) ile değişmesi hâlinde buna da amid denmesidir. Örneğin (CH3)2NLi, lityum dimetilamid'dir.

Nikotinamid adenin dinükleotid (NAD+) hücrelerde bulunan önemli bir koenzimdir. Elektron taşıyarak indirgenme potansiyelinin moleküller arasında aktarılmasında rol oynar.

Nitrat, (kim. sembol NO3-), kimyada bir azot ve üç oksijen atomundan oluşan bir nitrik asit (kim. sembol HNO3) tuzu iyonudur. Moleküler ağırlığı 62.0049'dur. Moleküler geometrisi düzlem üçgendir ve oksijen atomları arasındaki açı 120 derecedir.

Sülfat iyonu, inorganik kimyada bir sülfür atomu ile bunu tetrahedral yapıda çevreleyen dört eş oksijen atomundan oluşan, negatif yüklü bir anyondur. Ampirik formülü SO42- ve moleküler ağırlığı 96,06 daltondur. Hidrojenle birleştiğinde sülfürik asit oluşturur. Ayrıca,Dimetil sülfat gibi organik sülfatlar, kovalent bileşiklerdir ve sülfürik asidin esterleridir.
- Sülfürik asitte metalin eritilmesi
- Sülfürik asidin bir metal hidroksit veya oksit ile reaksiyonu
- Metal sülfür veya sülfitlerin oksidasyonu

Gümüş nitrat en önemli gümüş tuzudur. Renksiz ağır kristallerden oluşur. Tıpta dağlamak maksadıyla kullanılır ve antibakteriyel özelliği vardır. Bu özelliğinden dolayı siğil tedavisinde sıkça kullanılır. Ayrıca deriyi ve organik maddeleri karartmada tercih edilir. Deriyi kararttığından cehennem taşı ismini almıştır. Suda ve alkolde kolayca çözündüğünden birçok gümüş bileşiklerinin elde edilmesinde ilkel madde olarak kullanılır. En çok kullanıldığı yerler, başta fotoğrafçılık olmak üzere mürekkepler, saç boyası yapımı ve gümüş kaplamacılığıdır.bileşenleri gümüş ve nitrik asittir. Sentezi ise örnekteki formüle göre yapılır:
- Ag + 2 HNO3 → AgNO3 + NO2 + H2O
Esterlerin su alarak alkol ve asitlere ayrışması reaksiyonudur. Sabunlaşma esterleşmenin tersi olan bir reaksiyondur.Sabunlaşma denilince esterlerin Hidrolizi akla gelmektedir. Bu tepkimenin gerçekleşmesi için hidroksitlerin sulu çözeltisi daha doğru Natriıum hidroksit ya da esterleri parçalaya bilen özel enzimler gerekmektedir. Bitkisel ya da hayvansal yağların sabunlaşması sonucu üç değerli bir alkol olan Gliserin ile yağ asidi oluşur. Sabunlaşma sodyum hidroksit ya da potasyum hidroksit ile yapılırsa yağ asidi yerine bunun sodyum tuzu ya da potasyum tuzu elde edilir. Sabunlaşma temelde bir çeşit Hidroliz reaksiyonudur.

Asetat genellikle sulu çözeltiler içinde bulunan negatif iyon ya da anyon. Kimyasal formülü C2H3O2-,CH3CO2- veya CH3COO- şeklinde ifade edilir. Asetik asidin tuzu veya esteridir. Sanayide yılda 5 milyar kilogram asetik asit asetat üretiminde kullanılır. Doğada, asetat sentez için en yaygın yapı taşıdır. Örneğin, yağ asitleri büyüyen yağ asidi için asetat iki karbon atomu bağlanarak üretilir.
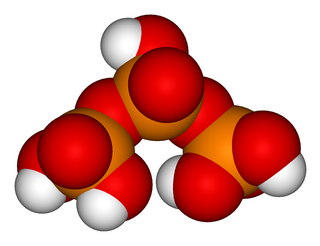
H5P3O10 formülüne sahip trifosforik asit (ayrıca tripolifosforik asit), yoğunlaştırılmış bir fosforik asit formudur. Fosforik asitler ailesinde, pirofosforik asitten sonra da difosforik asit olarak da adlandırılan H4P2O7'den sonraki bir sonraki polifosforik asittir.
Karboksilik asitlerden 3C'a sahip olan propiyonik asit içerdiği hidrojen bağları ile güçlü olup kaynama noktası diğer fonksiyonel gruplardan (sırasıyla) Alkol-Keton-Aldehit-Eter büyüktür. Propionik asit CH3CH2CO2H kimyasal formülüne sahip doğal olarak oluşan bir karboksilik asittir. Vücut kokusuna benzeyen keskin ve hoş olmayan bir kokuya sahip bir sıvıdır. CH3CH2CO2− anyonu ile propiyonik asidin tuzları ve esterleri, propiyonatlar veya propanoatlar olarak bilinir.
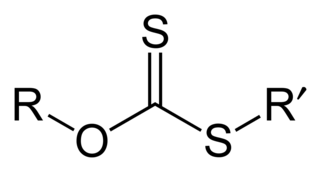
Bir ksantat, bir ksantik asidin tuzu veya esteridir. Ksantik asit tuzunun formülü [R−O−CS
2]−
M+
'dır. Ksantat aynı zamanda [R−O−CS
2]−
anyonunu da ifade eder. Ksantik asitlerin genel formülü R−O−C(=S)−S−H'dir, etil ksantik asit gibi, bir ksantik asit esterinin formülü ise R−O−C(=S)−S−R' şeklindedir; burada R ve R', organik gruplardır. Ksantat adı, Antik Yunancada "sarımsı, altın" anlamına gelen xanthos'tan (ξανθός) türetilmiştir ve çoğu ksantat tuzu sarıdır.


 Bu yeniden konumlandırma iki oksijen atomununda daha az negatif yüklü olduğu anlamına gelebilir; bundan dolayı pozitif proton karboksilik grubuna artık daha zayıf bir şekilde bağlıdır. Bu proton bırakıldığında karboksilat iyonu daha kararlı hale gelir.
Bu yeniden konumlandırma iki oksijen atomununda daha az negatif yüklü olduğu anlamına gelebilir; bundan dolayı pozitif proton karboksilik grubuna artık daha zayıf bir şekilde bağlıdır. Bu proton bırakıldığında karboksilat iyonu daha kararlı hale gelir. 














