Alkanlar, (diğer bir deyişle Parafinler) sadece karbon (C) ve hidrojen (H) elementlerinin bulunduğu ve bu elementlerin birbirleriyle tekli bağ yaptığı doymuş alifatik organik bileşiklerin genel ismidir. Alkanlar birbirlerini 1 karbon ve 2 hidrojen ile takip eden bir homolog seri oluştururlar. Örneğin tek karbonlu metan, CH4 formülüne sahipken, çift karbonlu etan C2H6 kapalı formülüne sahiptir. Alkanlarda tüm atomlar tekli bağlarla birbirlerine bağlandığı ve Karbon atomunu bağlayabileceği en fazla Hidrojen atomunu bağladığından dolayı doymuş bileşikler kategorisine girerler. Doymuş hidrokarbonlardan olan alkanlar, CnH2n+2 n=1,2,3,.... genel formülüne sahiptir. Burada n'in 3 veya 3'ten büyük olması hâlinde sikloalkan denilen halkalı yapılar oluşabilmektedirler.

Alkenler yapılarında en az bir tane karbon-karbon (C=C) çift bağı içeren organik bileşiklerdir. Alkenlerin yapısında karbon-karbon çift bağı bulunduğundan ve bu karbonların yapabileceği en fazla hidrojenle bağ yapmamış olduğundan alkenler doymamış bileşikler kategorisine girerler. Alkenlerin yapısında sadece bir karbon-karbon çift bağının bulunması durumunda homolog seriler oluşturur. Bu homolog serilerin genel formülü CnH2n şeklindedir. Burada n-in en az 2 olma şartı vardır. Aşağıda en basit alken olan eten, yaygın ismiyle etilenin, çeşitli modellemelerle çizilmiş şekillerinin yanı sıra alkenlerin çeşitli şekillerdeki yazılış şekilleri de bulunmaktadır.
Kimya ve biyokimyada, yağ asidi, genelde uzun, alifatik kuyruklu bir karboksilik asittir. Uzun karboksilik yağ asitlerinden 4 karbonlu ve daha uzun zincirlileri yağ asidi olarak sayılır; doğal yağları (trigliseritleri) oluşturan yağ asitlerinden söz ederken ise bunların en az 8 karbonlu olduğu varsayılabilir. Çoğu doğal yağ asitlerinin çift sayılı karbon atomu vardır, çünkü bunların biyolojik sentezlerinde iki karbon atomlu asetat kullanılır.

Sakkaroz veya diğer adlarıyla sükroz veya çay şekeri, C12H22O11 formülüyle gösterilen ve bir glukoz ve bir fruktoz molekülünün bir araya gelmesiyle meydana gelen disakkarittir. Sakkarozun sistematik adı β-D-fruktofuranozil-(2→1)-α-D-glukopiranosit şeklindedir. İnsan beslenmesinde çok önemli bir yere sahip olan sükroz, sadece bitkiler tarafından üretilir. Sakkarozun dünyadaki toplam yıllık üretim miktarı 150 milyon tonun üzerindedir.
Hidrojenasyon, bir kimyasal reaksiyon sınıfıdır ve organik bileşiklere hidrojen (H2) eklenmesi işlemidir. Hidrojenasyon, özellikle doymamış organik bileşikler (alkenler, alkinler, ketonlar ve nitriller ) için önemli bir reaksiyondur. Genellikle basınç altında katalizörler yardımı ile direkt hidrojen eklemesi ile gerçekleştirilir. Hidrojenasyon için en klasik örnek, alkenlerdeki doymamış karbon kimyasal bağına bir hidrojenin ekleyerek, alkeni alkana dönüştürmektir. İlaç ve petrokimya endüstrisinde çok değişik uygulamaları vardır. Bu kimyasal işlemin tersi dehidrojenasyondur. Alkenlere hidrojenin katılması sonucunda Alkanlar oluşur. Alkankar sadece karbon-karbon tekli bağlara sahiptirler. Bu tepkimede katalizör kullanıldığından katalitik hidrojenleme olarak da adlandırılır. Alkenlere hidrojen katılma tepkimeleri ekzotermik tepkimeler olup oda sıcaklığında katalizörsüz tepkime gerçekleşmez. Burada katalizör kullanılarak tepkimenin oda sıcaklığında gerçekleşmesi sağlanır. Yalnız katalizörün etkisi bununla sınırlı kalmıyor. Kullanılan katalizör elde edilecek olan ürünün cis-Alkan ya da trans-Alkan olmasını etkilemektedir. Eğer kullanılan katalizör heterojen bir katalizör ise, (bir parça nikel, platin, paladyum) yani çözelti içerisinde heterojen olarak karışıyorsa katılan her iki hidrojen atomu alkenin aynı tarafına eklenir ve böylece cis-Alkan oluşur. Şayet bu katalizör çözelti içerisinde homojen olarak yayılan bir katalkizörse bu seferde trans-Alkan oluşmuş olacak.
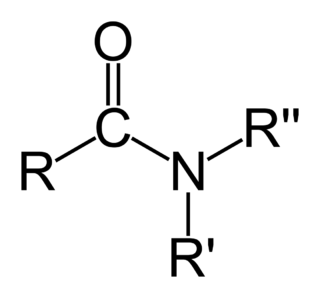
Kimyada amid sözcüğü iki anlama sahiptir: - Birinci anlamıyla amid, bir azot atomuna (N) bağlı bir karbonil grubu bulunduran bir organik fonksiyonel grup veya bu gruba sahip bir bileşiktir. - İkinci anlamıyla amid, bir azot anyonudur.

Aminler, amonyaktaki bir veya daha fazla hidrojen atomunun organik radikaller ile değiştirilmesi yöntemiyle türetilmiş organik bileşikler ve fonksiyonel gruplardır. Yapısal olarak aminler amonyağa benzerler, ama bir veya daha fazla hidrojen atomu, alkil veya aril gibi organik sübstitüentlerle yer değiştirmiştir. Bu kuralın önemli bir istisnası RC(O)NR2 tipi bileşiklerdir (C(O) karbonil grubuna karşılık gelir), bunlara amin yerine amid denir. Amidler ve aminlerin yapıları ve özellikleri farklı olduğu için bu ayrım kimyasal olarak önemlidir. Adlandırma açısında biraz akıl karıştırıcı olan bir nokta, bir aminin N-H grubunun N-M (M= metal) ile değişmesi hâlinde buna da amid denmesidir. Örneğin (CH3)2NLi, lityum dimetilamid'dir.

Eterler, iki organik kısmın bir oksijen atomu üzerinden birbirine bağ yapmış organik moleküllerdir. Eterlerin genel formülü R-O-R' şeklindedir. Buradaki R ve R' aynı olabileceği gibi farklı organik kısımlar da olabilirler.
Esterlerin su alarak alkol ve asitlere ayrışması reaksiyonudur. Sabunlaşma esterleşmenin tersi olan bir reaksiyondur.Sabunlaşma denilince esterlerin Hidrolizi akla gelmektedir. Bu tepkimenin gerçekleşmesi için hidroksitlerin sulu çözeltisi daha doğru Natriıum hidroksit ya da esterleri parçalaya bilen özel enzimler gerekmektedir. Bitkisel ya da hayvansal yağların sabunlaşması sonucu üç değerli bir alkol olan Gliserin ile yağ asidi oluşur. Sabunlaşma sodyum hidroksit ya da potasyum hidroksit ile yapılırsa yağ asidi yerine bunun sodyum tuzu ya da potasyum tuzu elde edilir. Sabunlaşma temelde bir çeşit Hidroliz reaksiyonudur.

Kimyada radikaller eşleşmemiş elektronu olan atom, molekül veya iyonlardır. Bu eşleşmemiş elektronlar genelde son derece reaktiftir. Radikaller, yanma, atmosfer kimyası, polimerleşme, plazma kimyası, biyokimya ve pek çok başka kimyasal süreçte önemli rol oynar. Örneğin, insan fizyolojisinde, süperoksit ve azot oksit, damar tonusu gibi pek çok biyolojik süreci düzenler. Radikal ve serbest radikal terimleri genelde eşanlamlı kullanılmakla beraber, bir radikal bir çözelti kafesi içinde hapsolmuş veya başka bir moleküle bağlanmış durumda olabilir. 1900'de Michigan Üniversitesi'nde Moses Gomberg tarafından betimlenen trifenilmetil radikali, ilk tespit edilmiş organik serbest radikal olmuştur.
Katılma tepkimeleri, bir organik molekülün yapısına dışarıdan başka bir molekülün katılmasıdır. Organik kimyada yapısında karbon-karbon çift bağı (Alken) ya da karbon-karbon üçlü bağı (Alkin) bulunduran molekülerlerin yapısına dışarıdan en az iki elementin girmesiyle gerçekleşen tepkimelerdir. İşte bu tepkimeler sonucu yapısında çoklu bağ bulunduran moleküldeki çoklu bağlar kırılarak yerlerine tekli bağlar oluşur.

Markovnikov kuralı, organik kimyada asimetrik alkenlere hidrojen halojenürlerin karbon-karbon çift bağlarına katılmasını öngörür. Bu kurala göre, asimetrik alkenlere hidrojen halojenürler katıldığında, hidrojen atomu her zaman en fazla hidrojen atomuna sahip olan karbon atomuna bağlanır. Bu da açıkta kalan halojen atomunun fazla dallanma yapan ya da hidrojen bakımından fakir olan karbon atomuna bağlanması anlamına gelir. Bu etki suyun alkenlere katılması esnasında da gözlenir. Burada su molekülündeki H- atomu en az dallanmış karbon atomuna bağlanırken, OH-grubu ise en fazla dallanma yapmış karbon atomuna bağlanır. Rus kimyager Vladimir Markovnikov tarafından 1870'te önerilmiştir.
Halojenleme veya halojenasyon, bir bileşiğe bir veya daha fazla halojenin katılmasını gerektiren kimyasal bir reaksiyondur. Alkenler, klor ve brom gibi halojenlerle, nükleofillik özelliği göstermeyen çözücüler içerisinde hızla tepkimeye girerler ve dihalojenleri oluştururlar. Bromun katılması daha kolay takip edilebilmektedir. Çünkü kırmızı-kahve rengi olan Brom çözeltisinin rengi ortadan kalkar. Bu yöntem özellikle çift bağların varlığını kanıtlamada kullanılır. Burada alken doymamış bir molekül olduğu için bromla tepkimeye girerken, alkanlar ise ortamda radikal bir çözelti olmadığı sürece tepkime vermez. Genel itibarıyla bu tepkimeler ya oda sıcaklığında ya da soğuk bir ortamda inert halojen çözücülerinin (CCl4) varlığında uygulanır.
HCl veya HBr gibi halohidrik asitlerin alkenlere katılımıyla haloalkanlar meydana gelir. Alkenlerde hidrojen ve Halojenlerin katılmalarında iki farklı durum ortaya çıkar. Eğer katılmaya giren alken eten gibi sadece birincil karbonlardan oluşan bir alken ise tepkime yandaki gibi sonuçlanır.

Endüstride küçük moleküllü alkollerin elde edilmesi için kullanılan bir yöntemdir. Bu yöntem alkenlerin hidrasyonu olarak da adlandırılmaktadır. Su kötü bir nüklefil olduğu için genellikle alkenlerle su katma tepkimeleri istenilen ürünü yani alkolleri vermezler. Bu yüzden bu tepkimeler çoğunlukla bir asit katalizörün varlığında gerçekleştirilir. Sülfürik asit ve fosforik asit alkenlerin hidrasyonu esnasında en sık kullanılan asitlerdir. Hidrasyon tepkimeleri genel itibarıyla Markownikow-Kuralı çerçevesinde gerçekleşen bir tepkimedir.
Alkenler sülfürik asitin katılması soğuk bir ortamda bile tepkime verip Alkil hidrojen sülfat bileşiklerini vermektedir. Genel itibarıyla bu tepkime alkenlere hidrojen halojen katılma tepkimeleriyle benzerlik göstermektedir.
Nükleofil ismi, atomun artı kısmı manasına gelen nucleo ve Yunancada seven manasına gelen philos kelimelerinden oluşmaktadır. İsimden de anlaşılacağı gibi nükleofiller artı parçacıkları seven artı merkez arayışı içinde olan moleküllerdir. Bu tür tepkimelerde nükleofiller yani bir çift ortaklaşmamış elektrona sahip molekül, bir alkil halojenürün halojen kısmıyla yer değiştrir işte bu şekilde gerçekleşen yer değişikliklerine Nükleofil yer değiştirme tepkimeleri denir. Elektronegatif halojen elektronları kendine doğru çektiğinden dolayı Karbon otomu üzerinde kısmi bir pozitif yük oluşmuş oluyor. Bu tepkimede de görüldüğü gibi bir yer değiştirme işlemi vardır.
Alkin halojenürlerin katıldıkları bir başka tepkime çeşidiyse ayrılma tepkimeleridir. Bu tepkime esnasında molekülün yapısında bulunan XY gibi bir molekül alkil halojenürlerin yapısından ayrılır bunun sonucunda da çoklu bağlar oluşmaktadır.
Alkenler sülfürik asitin katılması soğuk bir ortamda bile tepkime verip Alkil hidrojen sülfat bileşiklerini vermektedir. Genel itibarıyla bu tepkime alkenlere hidrojen halojen katılma tepkimeleriyle benzerlik göstermektedir.
Karbanyon, karbonun üç değerlikli olduğu ve formal yükü negatif olan bir anyondur.