Hidroliz işlemi suyu oluşturan hidrojen ve oksijen elementlerinin birbirinden ayrılması ile sonuçlanan bir işlemdir. Bazı kaynaklarda hidroliz, moleküllerin su ilavesiyle daha fazla sayıda parçacık oluşturması olarak da geçer. Hidroliz, su ile bir kimyasal bağın parçalanmasıdır yani bir kimyasal reaksiyondur. Hidroliz genel olarak suyun nükleofil olduğu ikame(yer değiştirme reaksiyonu), eliminasyon(organik reaksiyon türü) ve solvasyon (çözme) reaksiyonları için kullanılır.

İyon ya da yerdeş, bir veya daha çok elektron kazanmış ya da yitirmiş bir atomdan oluşmuş elektrik yüklü parçacıktır. Atomlar kararsız yapılarından kurtulmak ve kararlı hale gelebilmek için elektron alırlar ya da kaybederler. Bunun için de başka bir atomla ya da kökle bağ kurarlar.

Kimyasal bağ, atomların veya iyonların molekülleri, kristalleri ve diğer yapıları oluşturmak üzere birleşmesidir. Bağ, iyonik bağlar'da olduğu gibi zıt yüklü iyonlar arasındaki elektrostatik kuvvetten veya kovalent bağ'larda olduğu gibi elektronların paylaşılmasından veya bu etkilerin bazı kombinasyonlarından kaynaklanabilir. Açıklanan kimyasal bağların farklı mukavemetleri vardır: kovalent, iyonik ve metalik bağlar gibi "güçlü bağlar" veya "birincil bağlar" ve dipol-dipol etkileşimleri, London dağılım kuvveti ve hidrojen bağı gibi "zayıf bağlar" veya "ikincil bağlar" vardır.

Redoks atomların oksidasyon durumlarının değiştiği bir tür kimyasal reaksiyondur. Redoks reaksiyonları, kimyasal türler arasında elektronların fiili veya biçimsel aktarımı ile karakterize edilir, çoğunlukla bir tür oksidasyona, diğer türler indirgemeye uğrar. Elektronun çıkarıldığı kimyasal türlerin indirgenmiş olduğu söyleniyor. Başka bir deyişle:
- Oksidasyon, elektronların bir atom ya da molekülden ayrılmasını sağlayan kimyasal tepkimedir.
- Redüksiyon, bir atomun elektron almasını sağlayan kimyasal tepkimedir.

Organik kimyada bazı atom halkalarının yapısı beklenenin üstünde kararlıdır. Doymamış bağlar, yalın elektron çiftleri veya boş orbitallerden oluşan konjüge bir halkanın konjüge olmasından beklenecek kararlılıktan daha yüksek bir kararlılık gösterme özelliğine aromatiklik denir. Aromatiklik, halkasal delokalizasyon ve rezonansın bir belirtisi olarak da düşünülebilir.
Floroantimonik asit (HSbF6) hidrojen florür ve antimon pentaflorürün farklı oranlardaki karışımıdır. Bu karışımlardan 1:1 kombinasyonu, bilinen en güçlü süperasit formunu oluşturur. Öyle ki, bu form, hidrokarbonları iyonize ederek karbokatyonlar ve H2 oluşturabilmektedir.

Enantiyoselektif sentez ya da asimetrik sentez, bir kimyasal sentez şeklidir. IUPAC, bir veya daha fazla yeni kiralite elementinin bir substrat molekülünde oluşturulduğu ve stereoizomerik ürünleri eşit olmayan miktarlarda üreten kimyasal reaksiyon olarak tanımlanır.

Trihidridoboron, boran veya borin, BH3 kimyasal formülü ile gösterilen dengesiz ve oldukça reaktif bir moleküldür. Boran karbonilin BH3(CO) hazırlanması, boran kimyasının araştırılmasında büyük rol oynamıştır. Ancak, BH3 molekül türleri çok güçlü Lewis asidilerdir. Sonuç olarak, oldukça reaktifdir ve doğrudan bir akış sisteminde, sürekli olarak üretilen, geçici bir ürün olarak veya lazerle çıkarılmış atomik borun hidrojen ile reaksiyonundan doğrudan gözlenebilir.
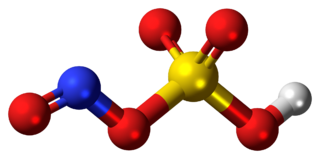
Nitrozilsülfürik asit, NOHSO4 formülüne sahip bir kimyasal bileşiktir. Endüstriyel olarak kaprolaktam üretiminde kullanılan renksiz bir katıdır. Daha önce sülfürik asit üretmek için öncü oda işleminin bir parçasıydı. Bileşik, sülfürik asit ve nitröz asidin karışık anhidritidir.

Bromöz asit, HBrO2 formülüne sahip bir inorganik bileşiktir. Konjugat bazının -bromitlerinin- tuzları izole edilmiş olmasına rağmen, kararsız bir bileşiktir. Asidik çözeltide, bromitler broma ayrışır.

İzosiyanik asit, 1830'da Liebig ve Wöhler tarafından keşfedilen HNCO formülüne sahip bir kimyasal bileşiktir. Kaynama noktası 23.5 °C olan uçucu ve zehirli renksiz bir maddedir. İzosiyanik asit, organik kimya ve biyolojide en yaygın olarak bulunan dört element olan karbon, hidrojen, azot ve oksijen içeren en basit kararlı kimyasal bileşiktir.

Kimyada, bir tuz köprüsü iki kovalent olmayan etkileşimin bir kombinasyonudur. İyon eşleştirme, kimyada, biyolojik sistemlerde, farklı materyallerde ve iyon çifti kromatografisi gibi birçok uygulamada en önemli kovalent olmayan kuvvetlerden biridir. Proteinlerin entropik olarak elverişsiz katlanmış konformasyonuna kararlılık sağlayan en yaygın faktördür. Kovalent olmayan etkileşimlerin nispeten zayıf etkileşimler olduğu bilinmesine rağmen, küçük stabilize edici etkileşimler bir araya geldiğinde konformer kararlılığına büyük derece bir atkı gerçekleştirebilirler. Sadece proteinlerde değil, tuz köprüleri aynı zamanda supramoleküler kimyada da bulunabilirler.

Bir Grignard reaktifi veya Grignard bileşiği, X'in bir halojen ve R'nin normalde bir alkil veya aril olduğu organik bir grup olduğu genel formül R−Mg−X'e sahip kimyasal bir bileşiktir. İki tipik örnek, metilmagnezyum klorür Cl−Mg−CH
3 ve fenilmagnezyum bromür (C
6H
5)−Mg−Br'dir. Organomagnezyum bileşiklerinin bir alt sınıfıdır.
Enzim katalizi, biyolojik bir molekül olan "enzim" tarafından sağlanan, bir sürecin hızındaki artıştır. Enzimlerin çoğu proteindir ve bu tür işlemlerin çoğu kimyasal reaksiyonlardır. Enzim içinde, genellikle kataliz aktif bölge olarak adlandırılan lokalize bir bölgede gerçekleşir.
Pauling'in kuralları,1929'da Linus Pauling tarafından iyonik bileşiklerin kristal yapılarını tahmin etmek ve rasyonelleştirmek için yayınlanan beş kuraldır.

Karbon Yılanı, şekerin konsantre sülfürik asit ile dehidrasyon reaksiyonu gerçekleştirilmesi ile oluşan, genellike kimya derslerinde yapılan deneylerden biridir. Granül sofra şekeri (Sakkaroz) dehidrasyon reaksiyonuna uğrayarak katı-sıvı bir karışıma dönüşür.
Elektrofilik aromatik sübstitüsyon, bir aromatik sisteme bağlı bir atomun bir elektrofil ile değiştirildiği organik reaksiyondur. En önemli elektrofilik aromatik sübstitüsyonlardan bazıları aromatik nitrolama, aromatik halojenasyon, aromatik sülfonasyon, alkilasyon ve açilasyon tipindeki Friedel– Crafts reaksiyonudur.

Reimer–Tiemann reaksiyonu, fenollerin orto-formilasyonu için kullanılan kimyasal bir reaksiyondur. Bu reaksiyon ilk olarak Karl Reimer ve Ferdinand Tiemann tarafından rapor edildi.

Kimyada ikili bağ veya çift bağ, iki atom arasında, tekli bağdaki iki elektrona karşılık dört bağ elektronu içeren kovalent bir bağdır. İkili bağlar en yaygın olarak iki karbon atomu arasında, örneğin alkenlerde meydana gelir. Birçok ikili bağ iki farklı element arasında bulunur: örneğin, bir karbon atomu ile bir oksijen atomu arasındaki bir karbonil grubunda. Diğer yaygın ikili bağlar azo bileşiklerinde (N=N), iminlerde (C=N) ve sülfoksitlerde (S=O) bulunur. Bir iskelet formülünde, bir ikili bağ, bağlı iki atom arasında iki paralel çizgi (=) olarak çizilir; tipografik olarak bunun için eşittir işareti kullanılır. İkili bağlar kimyasal gösterimde Rus kimyager Alexander Butlerov tarafından tanıtılmıştır.
Karbon-karbon bağı, iki karbon atomu arasındaki kovalent bir bağdır. En yaygın şekli tekli bağdır: iki atomun her birinden birer tane olmak üzere iki elektrondan oluşan bir bağ. Karbon-karbon tekli bağı bir sigma bağıdır ve karbon atomlarının her birinden bir hibridize orbital arasında oluşur. Etanda orbitaller sp3-hibridize orbitallerdir, ancak diğer hibridizasyonlara sahip karbon atomları arasında oluşan tek bağlar meydana gelir. Aslında, tekli bağdaki karbon atomlarının aynı hibridizasyona sahip olması gerekmez. Karbon atomları ayrıca alken adı verilen bileşiklerde çift bağ veya alkin adı verilen bileşiklerde üçlü bağ oluşturabilir. Bir çift bağ, sp2-hibritleşmiş bir orbital ve hibritleşmeye dahil olmayan bir p-orbitali ile oluşturulur. Üçlü bağ, sp-hibritleşmiş bir orbital ve her atomdan iki p-orbitali ile oluşturulur. P-orbitallerinin kullanımı bir pi bağı oluşturur.
















