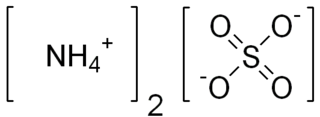Kalsit, kimyasal formülü CaCO3 olan kristalleşmiş kalsiyum karbonat. Saydam, beyaz, sarı, rustik yeşil ve mavimsi renkte olabilir. Sertliği 3, özgül ağırlığı 2.71'dir. Soğuk ve seyreltik hidroklorik asitte (tuz ruhu) şiddetli bir köpürme ile ayrışır. Çakı ile çizilir. CO2'li sularda çözünerek Ca(HCO3)2 yapar.

Baryum (Yunanca'da βαρυς = ağır), sembolü Ba olan kimyasal bir elementtir. Ağır manasına gelen "barys" kelimesinden türemiştir. İngilizcede Barite ağırlık yoğunluk manasında kullanılmaktadır. Baryum elementinin atom numarası 56 olup Periyodik tablonun 6. sırasında ve 2. grubunda bulunur. 2. grupta bulunması özelliğinden dolayı Baryum bir toprak alkali metalidir. Baryum ilk defa 1774 yılında İsveçli kimyacı Carl Wilhelm Sheele tarafından tanımlanmıştır. Baryum element halinde beyaz-gri metalik rengindedir fakat yüksek reaktivitelikten dolayı element halinde bulunmaz. Baryum'un hemen hemen bütün bileşikleri ise zehirlidir. Metalik Ba yakıldığında elma yeşili bir renk verir. Metalik halde saklanması çok zordur. Aktif bir element olduğu için su, hava ve asitlerle kolayca reaksiyon verir. Toprak alkali grup içerisinde doğada en yaygın bulunan element Kalsiyum(Ca)dur. Bu sınıftaki metallerin özellikleri birbirine benzemesine karşın bilhassa Kalsiyum, Stronsiyum, Baryum diğerlerinden ayrılır. Bu üç element adi derecede suyu ayrıştırarak Hidrojen açığa çıkarır ve Hidroksit(OH) oluştururlar. Bu Hidroksitler de ısıtıldığında su kaybederek Oksit haline dönmektedirler. Karbonatları ısı karşısında kolay ayrışmasına karşın Baryum Karbonat (BaCO3) en zor ayrışanıdır. Sülfatları suda hemen hemen hiç erimez.

Kalsiyum, toprak alkalileri grubundan metalik bir element. Sembolü "Ca"dır. İsmi Latincede “kireç” anlamına gelen “calx” sözcüğünden gelmektedir. İlk defa 1808'de Humphry Davy tarafından kalsiyum hidroksitten elektroliz yoluyla elde edilmiştir.

Sodyum karbonat, (çamaşır sodası, kristal soda ve soda külü olarak da bilinir) Na2CO3 formülüne sahip değişik hidratları olan bir inorganik bileşiktir. Bütün formları beyaz, suda çözünür tuzlardır. Tüm formları güçlü bir alkali tada sahiptir ve suda orta derecede alkali çözeltiler verir. Tarihsel olarak sodyum bakımından zengin göl sularından veya sodyum bakımından zengin topraklarda yetişen bitkilerin küllerinden çıkarıldı. Bu sodyum açısından zengin bitkilerin külleri, potas üretmek için kullanılan odun küllerinden belirgin şekilde farklı olduğundan, "soda külü" olarak anıldı. Günümüzde ise, Solvay işlemi ile sodyum klorür ve kireç taşından büyük miktarlarda üretilmektedir.
İnorganik kimya veya anorganik kimya; organik olmayan, yani karbon-hidrojen bağı içermeyen bileşiklerin özelliklerini ve kimyasal davranışlarını inceleyen kimya dalı. Anorganik ve organik kimyayı birleştiren organometalik bileşikler, organometalik kimya adında başka bir dalı oluşturur.

Kireç, kireç taşının çeşitli derecelerde (850-1450 °C) pişirilmesi sonucu elde edilen, suyla karıştırıldığında, tipine göre havada veya suda katılaşma özelliği gösteren, beyaz renkli, inorganik esaslı bir bağlayıcı madde türüdür.

Alçı taşı, kalsiyum sülfat dihidrattan oluşan yumuşak bir sülfat mineralidir ve kimyasal formül CaSO4 · 2H2O'dur. Alçıtaşı ayrıca selenitin yarı saydam kristalleri olarak kristalleşir. Aynı zamanda bir evaporit minerali ve anhidritin hidrasyon ürünü olarak oluşur. İçinde su bulunan kalsiyum sülfat minerali, tek veya ikiz sütunlar hâlinde billûrlanır. Alçı billurlarına kil ve marn içinde veya tuzlu ve alçılı dağların boşluklarında rastlanır.

Kalsiyum hidroksit, sönmemiş kirece su ilave edilmesiyle elde edilen kimyasal bileşiktir. Kristal beyaz renkli toz halde bulunur. Suda çözündüğünde hamurumsu görüntü veren bir alkalidir. Geleneksel adı söndürülmüş kireç veya hidratik kireçtir.

Anhidrit, susuz kalsiyum sülfat (CaSO4) yapısında, kayaç oluşturan önemli bir mineral. Kimyasal açıdan jips (alçıtaşı) ile arasındaki tek fark, kristalleşme suyunun olmamasıdır, nitekim nemli ortamlarda molekülüne su alarak jipse dönüşür. Anhidrit genellikle tuz birikintilerinde kayatuzu ve jipsle bir arada bulunur.

Küprik sülfat ya da sadece bakır sülfat olarak da bilinen Bakır (II) sülfat, kimyasal formülü CuSO4 olan bir kimyasal bileşiktir. Bu tuzun hidrasyon derecelerine bağlı olarak bir dizi farklı bileşikleri mevcuttur. Susuz formu soluk yeşil ya da grimsi beyaz bir toz olmasına karşın en çok bilinen pentahidrat (CuSO4•5H2O) formu, parlak mavi renktedir. Çok az miktardaki CuSO4•5H2O çevreye çok zehirlidir, gözleri ve cildi tahriş eder ve yutulduğunda zararlı da olabilir. Oktahedral moleküler geometriye ve paramanyetik özelliğe sahip olan bakır (II) sülfat ekzotermik olarak suda çözünürek [Cu(H2O)6]2+ kompleksini oluşturur. Bakır (II) sülfat "mavi vitriyol", "göztaşı" ve "göktaşı" olarak da bilinmektedir.
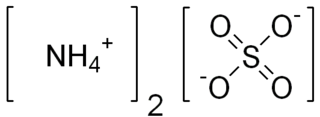
Amonyum sülfat, (NH4)2SO4 formülüne ve çok sayıda ticari kullanıma sahip bir inorganik tuzdur. Toprak gübresi olarak yaygın bir şekilde kullanılır. %21 azot ve %24 kükürt içerir.

Sodyum bisülfat, diğer bir adı sodyum hidrojen sülfat (NaHSO4) olan bu kimyasal madde asit tuz karakterlidir. Kuru halde iken güvenli bir şekilde nakledilebilir ve depolanabilir. Susuz formu higroskopiktir. Sodyum bisülfat suda hidroliz olarak asidik çözelti verir. 1 Molarlık çözeltisinin pH değeri 1 den küçüktür. Sodyum bisülfat yavaşça ısıtılırsa suyunu kaybederek sodyum pirosülfata dönüşür.
- 2NaHSO4 → Na2S2O7 + H2O

Potasyum sülfat, formülü K2SO4 olan, yanmaz, suda çözünebilen beyaz kristal yapıda bir potasyum tuzudur. Genellikle potasyum ve kükürt kaynağı olarak gübrelerde kullanılır.
Yer altı suyu; birçok şehrin, havzanın ve sanayi tesisinin su ihtiyacını karşılamak üzere faal durumda olan doğal su kaynağıdır.

Evaporit, sulu bir çözeltinin buharlaşmasıyla kristalleşme ve yoğunlaşma sürecinde sonuçlanır. Evaporit suda çözünen mineral sedimentin (mineralin) ismidir. İki çeşit tuz taşı birikintisi vardır:
- Okyanus birikintisi olarak da bilinen marine ve göller gibi suyun ana bloklarında bulunmaktadır.
- Evaporit tuz taşları çökelti kayaları olarak bulunur.

Desikatör, içinde nem alıcı madde bulunan kap. Nemden etkilenen maddelerin nemden korunması, örneklerden suyun çekilmesi ve maddenin kuru hâlde kalması için laboratuvarlarda kullanılır. Kalın camdan veya alüminyumdan yapılırlar.

Kaliş bir tortul kayaçtır. Sertleştirilmiş doğal çimento kalsiyum karbonat ile birleşmiş bu bağlar, çakıl,kum, kil ve alüvyon gibi diğer materyallerle birleşerek kalişi oluşturur. Dünya genelinde Aridisol ve Morrisol'un bulunduğu toprak türlerinde görülen kayaçtır. Genellikle kurak ve yarı kurak bölgeleri kapsayarak merkez ve Batı Avustralya, Kalahari Çölü, Amerika’nın bazı yüksek ovalarında, Sonora Çölü ve Suudi Arabistan'ın doğusu AL-HASA’ da bulunur. Kaliş sert toprak kalsit- beton ve Hindistan'da da dayanıklı taş kum ve çakıl karışımı (kankar) olarak da bilinir. Caliche İspanyolca bir kelime olarak bilinir. Orijinali Latincedeki calx kelimesidir. Anlamı kireç taşı(CaO)'tir.

Baryum klorür, BaCl2 formüllü inorganik bir bileşik'tir. Bu bileşik baryum'un suda-çözünen en yaygın tuzlarından biridir. Diğer baryum tuzlarının çoğu gibi, baryum klorür beyaz toz halinde ve zehirlidir. Alevde sarı-yeşil renk verir. Ayrıca higroskopiktir, ilk önce dihidrat BaCl2(H2O)2' ye dönüşür.
Simya çalışmaları sayesinde daha sonra belirli kimyasal bileşikler veya bileşik karışımları olarak sınıflandırılan birçok kimyasal madde üretilmiştir.

Suyun sertliği veya sert su, yüksek mineral içeriğine sahip sudur. Suyun sertliği, büyük ölçüde kalsiyum ve magnezyum karbonatlar, bikarbonatlar ve sülfatlardan oluşan kireç taşı veya alçıtaşı birikintilerinden su sızdığında oluşur.