
Kireç taşı genellikle mercan, foraminifera ve yumuşakçalar gibi deniz canlılarının iskelet parçalarından oluşan bir karbonat tortul kayaçtır. Başlıca maddeleri kalsiyum karbonatın farklı kristal formları olan kalsit ve aragonit minerallerdir. Yakından ilişkili bir kaya, yüksek oranda mineral dolomit içeren dolomittir. Eski USGS yayınlarında, dolomit magnezyum kireç taşı olarak anılırdı, artık magnezyum eksikliği olan dolomitler veya magnezyum açısından zengin kalkerler olarak ayrılmıştır.

Dolomit, kalsiyum ve magnezyumlu karbonat birleşiminde meydana gelen bir mineral.

Kalsit, kimyasal formülü CaCO3 olan kristalleşmiş kalsiyum karbonat. Saydam, beyaz, sarı, rustik yeşil ve mavimsi renkte olabilir. Sertliği 3, özgül ağırlığı 2.71'dir. Soğuk ve seyreltik hidroklorik asitte (tuz ruhu) şiddetli bir köpürme ile ayrışır. Çakı ile çizilir. CO2'li sularda çözünerek Ca(HCO3)2 yapar.

Sodyum, periyodik cetvelde Na simgesi ile gösterilen ve atom numarası 11 olan element. Sodyum yumuşak ve kaygan bir metal olup alkali metaller grubuna aittir. Doğal bileşiklerin içinde bol miktarda bulunur. Yüksek oranda reaktiftir, sarı bir alevle yanar, su ile şiddetli reaksiyon verir ve havada hızla oksitlenir. Dolayısıyla, vazelin, gazyağı gibi hava ve su ile temasını kesecek bir ortamda saklanması gerekir.

Baryum (Yunanca'da βαρυς = ağır), sembolü Ba olan kimyasal bir elementtir. Ağır manasına gelen "barys" kelimesinden türemiştir. İngilizcede Barite ağırlık yoğunluk manasında kullanılmaktadır. Baryum elementinin atom numarası 56 olup Periyodik tablonun 6. sırasında ve 2. grubunda bulunur. 2. grupta bulunması özelliğinden dolayı Baryum bir toprak alkali metalidir. Baryum ilk defa 1774 yılında İsveçli kimyacı Carl Wilhelm Sheele tarafından tanımlanmıştır. Baryum element halinde beyaz-gri metalik rengindedir fakat yüksek reaktivitelikten dolayı element halinde bulunmaz. Baryum'un hemen hemen bütün bileşikleri ise zehirlidir. Metalik Ba yakıldığında elma yeşili bir renk verir. Metalik halde saklanması çok zordur. Aktif bir element olduğu için su, hava ve asitlerle kolayca reaksiyon verir. Toprak alkali grup içerisinde doğada en yaygın bulunan element Kalsiyum(Ca)dur. Bu sınıftaki metallerin özellikleri birbirine benzemesine karşın bilhassa Kalsiyum, Stronsiyum, Baryum diğerlerinden ayrılır. Bu üç element adi derecede suyu ayrıştırarak Hidrojen açığa çıkarır ve Hidroksit(OH) oluştururlar. Bu Hidroksitler de ısıtıldığında su kaybederek Oksit haline dönmektedirler. Karbonatları ısı karşısında kolay ayrışmasına karşın Baryum Karbonat (BaCO3) en zor ayrışanıdır. Sülfatları suda hemen hemen hiç erimez.

Kalsiyum, toprak alkalileri grubundan metalik bir element. Sembolü "Ca"dır. İsmi Latincede “kireç” anlamına gelen “calx” sözcüğünden gelmektedir. İlk defa 1808'de Humphry Davy tarafından kalsiyum hidroksitten elektroliz yoluyla elde edilmiştir.

Marn, kil ve kalsiyum karbonattan, değişik oranlarda tabii olarak meydana gelmiş karışımdır. Bir tortul kayaç olan marnların içlerindeki kireç taşı oranı %20 - %60 oranında değişir. Genellikle yeşilimsi renktedir ve asitte köpürürler. Kalsiyum karbonat, kile göre daha fazla ise buna kalker denir. Genel olarak sığ göllerde, bataklıklarda bulunur. Kalsiyum karbonat, muhtevasından dolayı Portland çimentosu imalatında ve asidik toprağı nötrleştirmek için zırai gayeyle, toprak ıslahında kullanılır.

Sodyum karbonat, (çamaşır sodası, kristal soda ve soda külü olarak da bilinir) Na2CO3 formülüne sahip değişik hidratları olan bir inorganik bileşiktir. Bütün formları beyaz, suda çözünür tuzlardır. Tüm formları güçlü bir alkali tada sahiptir ve suda orta derecede alkali çözeltiler verir. Tarihsel olarak sodyum bakımından zengin göl sularından veya sodyum bakımından zengin topraklarda yetişen bitkilerin küllerinden çıkarıldı. Bu sodyum açısından zengin bitkilerin külleri, potas üretmek için kullanılan odun küllerinden belirgin şekilde farklı olduğundan, "soda külü" olarak anıldı. Günümüzde ise, Solvay işlemi ile sodyum klorür ve kireç taşından büyük miktarlarda üretilmektedir.

Mermer, metomorfizma olayı sonucunda kalker ve dolomitik kalkerlerin yeniden kristalleşmesiyle meydana gelmiş bileşimdir. Bileşimlerinin %90-98'i CaCO3'ten (Kalsiyum karbonat) oluşmaktadır. Düşük oranda MgCO3 (Magnezyum karbonat) içermektedir. CaCO3 kristallerinden oluşan mermerlerde esas mineral “Kalsit” tir. Aynı zamanda az miktarda silis, silika, feldspat, demiroksit, mika, fluorin ve organik maddeler bulunabilir. Renkleri genellikle beyaz ve grimsidir. Fakat yabancı maddeler nedeniyle sarı, pembe, kırmızı, mavimtırak, esmerimsi ve siyah gibi renklerde de olabilirler. Mikroskop altında incelendiğinde, birbirine iyice kenetlenmiş "Kalsit Kristalleri"nden oluştuğu görülür.

Kimyasal bileşik, kimyasal bağlarla bir arada tutulan birden fazla kimyasal elementin atomlarını içeren birçok özdeş molekülden oluşan kimyasal maddedir. Dolayısıyla tek bir elementin atomlarından oluşan bir molekül bileşik değildir. Bir bileşik, diğer maddelerle etkileşimi içerebilen kimyasal reaksiyonla farklı bir maddeye dönüştürülebilir. Bu süreçte atomlar arasındaki bağlar kırılabilir ve/veya yeni bağlar oluşabilir.

Kireç, kireç taşının çeşitli derecelerde (850-1450 °C) pişirilmesi sonucu elde edilen, suyla karıştırıldığında, tipine göre havada veya suda katılaşma özelliği gösteren, beyaz renkli, inorganik esaslı bir bağlayıcı madde türüdür.

Kalsiyum hidroksit, sönmemiş kirece su ilave edilmesiyle elde edilen kimyasal bileşiktir. Kristal beyaz renkli toz halde bulunur. Suda çözündüğünde hamurumsu görüntü veren bir alkalidir. Geleneksel adı söndürülmüş kireç veya hidratik kireçtir.

Travertenler, kalsiyum karbonat (CaCO3) bileşimindeki kimyasal tortul kayaçlardır. Yer altı sularının içlerindeki kalsiyum karbonatın belirli koşullar altında çökmesi sonucu meydana gelirler. Bu çökelme zamanla yumuşak hatları olan travertenleri oluşturur. Çökelmede rol oynayan koşullar; buharlaşma, suyun içerdiği karbondioksit (CO2) miktarının azalması, suyun üzerindeki basıncın azalması gibi koşullardır.

Kalsiyum asetat asetik asitin kalsiyum tuzu. Ca(C2H3O2)2 formülü ile ifade edilir. Eski bir ismi kirecin asetatı olarak bilinir. Susuz hali çok higroskopiktir. Bundan dolayı monohidrat formu (Ca(CH3COO)2•H2O) yaygındır.
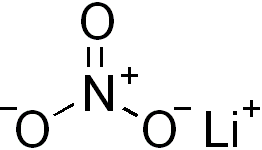
Lityum nitrat LiNO3 formüllü inorganik bileşik. Nitrik asitin lityum tuzudur. Lityum karbonat veya lityum hidroksitin nitrik asit ile reaksiyonundan elde edilir.

Bakır karbonat, oda sıcaklığında katı hâlde bulunan bir inorganik bileşiktir. Havadan nem çeker. Su ile tepkimeye girerek bakır karbonat hidroksite dönüşür. Bazik özellik gösterir. Boya ve pigment olarak kullanılır.
Potasyum karbonat, K2CO3 formülüne sahip inorganik bileşiktir. Suda çözünen beyaz bir tuzdur. Nem çekerek sıvılaşan ve genellikle nemli veya ıslak bir katı olarak görülür. Potasyum karbonat esas olarak sabun ve cam üretiminde kullanılır.

Kalsiyum nitrat, (Norveç güherçilesi) olarak da adlandırılır. Ca(NO3)2 formülüne sahip bir inorganik bileşiktir. Bu renksiz tuz havadan nem çeker ve genellikle bir tetrahidrat olarak bulunur. Esas olarak gübrelerde bileşen olarak kullanılırsa da başka uygulamalarda da kullanılır. Nitrokalsit, çiftlik gübresinin ahır veya mağaralarda olduğu gibi kuru bir ortamda beton veya kireç taşı ile temas ettiği yerlerde bir çiçeklenme olarak oluşan hidratlı bir kalsiyum nitrat olan bir mineralin adıdır. Kalsiyum amonyum nitrat dekahidrat ve kalsiyum potasyum nitrat dekahidrat dahil çeşitli ilgili tuzları bilinmektedir.
Kalsinasyon, katı kimyasal bileşiklerin ısıl işlemine atıfta bulunur; bu sayede bileşik, genellikle safsızlığı veya uçucu maddeleri uzaklaştırmak ve/veya termal ayrışmaya maruz kalmak amacıyla, ortamdaki sınırlı oksijen kaynağı altında erimeden yüksek sıcaklığa yükseltilir.

Suyun sertliği veya sert su, yüksek mineral içeriğine sahip sudur. Suyun sertliği, büyük ölçüde kalsiyum ve magnezyum karbonatlar, bikarbonatlar ve sülfatlardan oluşan kireç taşı veya alçıtaşı birikintilerinden su sızdığında oluşur.
























